Классификация и синтез гормонов — различия между версиями
Febor (обсуждение | вклад) (→Катехоламины) |
Sw986 (обсуждение | вклад) |
||
| Строка 15: | Строка 15: | ||
=== Пептидные гормоны === | === Пептидные гормоны === | ||
| − | Белково-пептидные гормоны представляют собой аминокислотные цепи. В случае, если количество аминокислотных остатков в цепи не превышает 20, гормон обычно называют пептидным, если цепь включает 20 аминокислотных остатков или более, гормон называют белковым (Goodman, 1994). Примерами пептидных гормонов являются окситоцин, вазопрессин и соматостатин. В количество (-100) белковых гормонов, описанных к настоящему времени, входят [[инсулин]], [[гормон роста]], кальцитонин и глюкагон. Некоторые из этих белков существуют как относительно простые, одиночные аминокислотные цепи, тогда как другие характеризуются наличием дисульфидных связей, соединяющих различные участки полипептидной последовательности, и имеют сложную четвертичную структуру. Некоторые белковые гормоны могут даже состоять из нескольких субъединиц, объединенных вместе в единую структуру. | + | Белково-пептидные гормоны представляют собой аминокислотные цепи. В случае, если количество аминокислотных остатков в цепи не превышает 20, гормон обычно называют пептидным, если цепь включает 20 аминокислотных остатков или более, гормон называют белковым (Goodman, 1994). Примерами пептидных гормонов являются [[окситоцин]], вазопрессин и соматостатин. В количество (-100) белковых гормонов, описанных к настоящему времени, входят [[инсулин]], [[гормон роста]], кальцитонин и глюкагон. Некоторые из этих белков существуют как относительно простые, одиночные аминокислотные цепи, тогда как другие характеризуются наличием дисульфидных связей, соединяющих различные участки полипептидной последовательности, и имеют сложную четвертичную структуру. Некоторые белковые гормоны могут даже состоять из нескольких субъединиц, объединенных вместе в единую структуру. |
Независимо от своего конечного строения все белково-пептидные гормоны синтезируются в эндокринных клетках подобно всем остальным белкам. Это означает, что синтез предшественников белковопептидных гормонов происходит на рибосомах при участии тРНК и мРНК в виде гораздо более длинных цепей но сравнению с теми, которые обнаруживаются в составе активного гормона. Такие препрогормоны содержат сигнальную информацию, указывающую, что белок предназначен для выделения из клетки. Первоначальные модификации этих молекул происходят в эпдоплазматическом ретикулуме, там, где располагаются рибосомы, и включают протеолитические реакции, которые приводят к удалению аминокислотных составляющих, включая сигнальную последовательность, и соответственному укорочению цепи. Сформировавшиеся в результате этих процессов прогормоны попадают затем в комплекс Гольджи, где подвергаются дальнейшему протеолитическому расщеплению и, возможно, присоединению молекул углеводов (гликозилирование) или фосфатных групп (фосфорилирование). После завершения этих модификаций от комплекса Гольджи отсоединяется участок мембраны, формирующий везикулу, в которой заключен сформированный гормон. Эта секреторная везикула остается в цитоплазме эндокринной клетки до момента получения соответствующего сигнала, стимулирующего повышение концентрации ионов кальция в клетке. Это в свою очередь приводит к тому, что секреторная везикула сливается с плазматической мембраной клетки и выделяет гормон во внеклеточное пространство путем экзоцитоза. Обычно запас пептидно-белковых гормонов в клетке ограничен, поэтому сигнал, стимулирующий секрецию клеткой гормона, допускает и его дополнительный синтез (Rhoades, Pflanzer, 2003). | Независимо от своего конечного строения все белково-пептидные гормоны синтезируются в эндокринных клетках подобно всем остальным белкам. Это означает, что синтез предшественников белковопептидных гормонов происходит на рибосомах при участии тРНК и мРНК в виде гораздо более длинных цепей но сравнению с теми, которые обнаруживаются в составе активного гормона. Такие препрогормоны содержат сигнальную информацию, указывающую, что белок предназначен для выделения из клетки. Первоначальные модификации этих молекул происходят в эпдоплазматическом ретикулуме, там, где располагаются рибосомы, и включают протеолитические реакции, которые приводят к удалению аминокислотных составляющих, включая сигнальную последовательность, и соответственному укорочению цепи. Сформировавшиеся в результате этих процессов прогормоны попадают затем в комплекс Гольджи, где подвергаются дальнейшему протеолитическому расщеплению и, возможно, присоединению молекул углеводов (гликозилирование) или фосфатных групп (фосфорилирование). После завершения этих модификаций от комплекса Гольджи отсоединяется участок мембраны, формирующий везикулу, в которой заключен сформированный гормон. Эта секреторная везикула остается в цитоплазме эндокринной клетки до момента получения соответствующего сигнала, стимулирующего повышение концентрации ионов кальция в клетке. Это в свою очередь приводит к тому, что секреторная везикула сливается с плазматической мембраной клетки и выделяет гормон во внеклеточное пространство путем экзоцитоза. Обычно запас пептидно-белковых гормонов в клетке ограничен, поэтому сигнал, стимулирующий секрецию клеткой гормона, допускает и его дополнительный синтез (Rhoades, Pflanzer, 2003). | ||
Версия 15:52, 15 июня 2014
Содержание
Классификация гормонов и их синтез
Источник:
Эндокриная система, спорт и двигательная активность.
Перевод с англ./под ред. У.Дж. Кремера и А.Д. Рогола. - Э64
Издательство: Олимп. литература, 2008 год.
Все известные гормоны могут быть разделены на группы в зависимости от своего химического состава и способа синтеза следующим образом: 1) стероиды; 2) пептиды/белки; 3) амины.
Стероидные гормоны
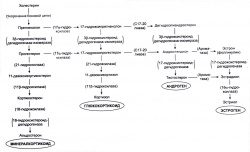
Стероидные гормоны являются производными холестерина; к этой группе относятся половые стероиды (андрогены, эстрогены, прогестины), которые продуцируются в половых железах, а также глюкокортикоиды и минералкортикоиды, которые синтезируются надпочечными железами. У человека основным андрогеном или мужским половым гормоном, циркулирующим в крови, является тестостерон. Подобным обрезом эстрогены представляют собой семейство женских половых гормонов. У человека основным эстрогеном является эстрадиол, а в группе прогестинов преобладает прогестерон. Кортизол является основным глюкокортикоидом у человека, а альдостерон — основным минералкортикоидом.
Поскольку предшественником всех стероидных гормонов является одно и то же соединение — холестерин, то основным фактором, определяющим преобладающий продукт эндокринной железы, будут ферментативные пути биосинтеза. Вместе с тем из-за строго определенных отклонений в ферментативном синтезе в продуктах, секретируемых железой, наряду с основным обычно выявляются небольшие количества другого гормона. Например, основная масса стероидов, которые синтезируют семенники, представлена тестостероном, но наряду с ним в небольших количествах образуется еще и кортизол, появление которого обусловлено присутствием небольшого количества ферментов, входящих в состав пути биосинтеза этого стероида.
Скорость образования стероидных гормонов определяется, как и в случае всех прочих ферментативных процессов, активностью фермента, определяющего скорость цепи реакций в целом, т. е. фермента, катализирующего самую медленную реакцию в биохимическом каскаде. Для всех стероидных гормонов такой ограничивающей скорость реакцией является превращение холестерина в прегненолон. Таким образом, факторы, которые увеличивают скорость образования стероидов, главным образом ускоряют формирование прегненолона, а также увеличивают потребление эндокринной железой холестерина из крови (Rhoades, Pflanzer, 2003).
Эндокринные железы, которые продуцируют стероиды, не способны накапливать вновь синтезированный гормон, поэтому по мере синтеза стероид выделяется в систему кровообращения и, соответственно, скорость секреции гормона в кровь равна скорости его продукции в клетках эндокринной железы.
Пептидные гормоны
Белково-пептидные гормоны представляют собой аминокислотные цепи. В случае, если количество аминокислотных остатков в цепи не превышает 20, гормон обычно называют пептидным, если цепь включает 20 аминокислотных остатков или более, гормон называют белковым (Goodman, 1994). Примерами пептидных гормонов являются окситоцин, вазопрессин и соматостатин. В количество (-100) белковых гормонов, описанных к настоящему времени, входят инсулин, гормон роста, кальцитонин и глюкагон. Некоторые из этих белков существуют как относительно простые, одиночные аминокислотные цепи, тогда как другие характеризуются наличием дисульфидных связей, соединяющих различные участки полипептидной последовательности, и имеют сложную четвертичную структуру. Некоторые белковые гормоны могут даже состоять из нескольких субъединиц, объединенных вместе в единую структуру.
Независимо от своего конечного строения все белково-пептидные гормоны синтезируются в эндокринных клетках подобно всем остальным белкам. Это означает, что синтез предшественников белковопептидных гормонов происходит на рибосомах при участии тРНК и мРНК в виде гораздо более длинных цепей но сравнению с теми, которые обнаруживаются в составе активного гормона. Такие препрогормоны содержат сигнальную информацию, указывающую, что белок предназначен для выделения из клетки. Первоначальные модификации этих молекул происходят в эпдоплазматическом ретикулуме, там, где располагаются рибосомы, и включают протеолитические реакции, которые приводят к удалению аминокислотных составляющих, включая сигнальную последовательность, и соответственному укорочению цепи. Сформировавшиеся в результате этих процессов прогормоны попадают затем в комплекс Гольджи, где подвергаются дальнейшему протеолитическому расщеплению и, возможно, присоединению молекул углеводов (гликозилирование) или фосфатных групп (фосфорилирование). После завершения этих модификаций от комплекса Гольджи отсоединяется участок мембраны, формирующий везикулу, в которой заключен сформированный гормон. Эта секреторная везикула остается в цитоплазме эндокринной клетки до момента получения соответствующего сигнала, стимулирующего повышение концентрации ионов кальция в клетке. Это в свою очередь приводит к тому, что секреторная везикула сливается с плазматической мембраной клетки и выделяет гормон во внеклеточное пространство путем экзоцитоза. Обычно запас пептидно-белковых гормонов в клетке ограничен, поэтому сигнал, стимулирующий секрецию клеткой гормона, допускает и его дополнительный синтез (Rhoades, Pflanzer, 2003).
Протеолитическое расщепление прогормона во время синтеза гормонов белковой природы приводит к большому разнообразию гормонов, продуцируемых эндокринной системой. Одна и та же молекула-предшественник может подвергаться различным модификациям, приводящим к образованию разнообразных конечных продуктов. Возможно, наилучшим примером подобных процессов является предшественник проопиомеланокортина (ПОМК), который содержит аминокислотные последовательности нескольких белково-пептидных гормонов, в число которых входят адренокортикотропный гормон (АКТГ), β-эндорфин и β-липотронный гормон (Krieger et al., 1980; Chretian, Seidah, 1981). Каким будет основной гормон, производимый конкретной эндокринной железой, синтезирующей ПОМК, будут определять специфические протеолитические ферменты, которые экспрессируют клетки этой железы. Например, клетки передней доли гипофиза содержат набор ферментов, который обеспечивает формирование АКТГ в качестве основного конечного продукта образования прогормона ПОМК. В то же время нейроны головного мозга, которые также продуцируют ПОМК, содержат ферменты, которые расщепляют эту молекулу-предшественник таким образом, что секретируется преимущественно β-эндорфин. Альтернативные варианты образования ПОМК обнаружены в плаценте, репродуктивных органах, желудочно-кишечном тракте и легких (Liotta et al., 1982; Margioris et al., 1982). Такая специфическая продукция различных гормонов из одного общего предшественника в зависимости от наличного спектра ферментов обладает определенным сходством с особенностями процессов биосинтеза стероидов.
Аминокислоты
Амины также известны под названием гормонов — производных аминокислот, включают соединения, образованные из аминокислоты тирозина. В эту группу входят тиреоидные гормоны (тироксин Т4 и трийодтиронин Т3) и катехоламины (адреналин и норадреналин). Несмотря на то что все они происходят от общей молекулы-предшественника, тиреоидные гормоны и катехоламины различаются во многих аспектах, включая их синтез, транспорт в кровеносной системе и механизм воздействия на клетки-мишени. Эти группы аминов будут рассмотрены по отдельности с учетом особенностей их биосинтеза.
Формирование тиреоидных гормонов зависит от поглощения фолликулярными клетками щитовидной железы тирозина и минерального йодида. Тирозин используется в качестве основы для построения тироглобулина, который представляет собой крупный гликопротеин, накапливающийся в фолликулярных клетках в значительных количествах. При поглощении йодида из крови тирозиновые остатки тироглобулина подвергаются йодированию посредством многоэтапной реакции, которая оканчивается формированием Т4 либо Т, в зависимости от количества атомов йода, связавшихся с тироглобулином. Первоначально тирюглобулин взаимодействует с одним или двумя ионами йода, что приводит к образованию монойодтирозина (МИТ) или дийодтирозина (ДЙТ) соответственно. На следующем этапе энзиматического синтеза тиреоидных гормонов к молекуле тирюглобулина присоединяется еще два атома йода, благодаря чему МИТ превращается в Т3, а ДЙТ — в Т4. На этом этапе тиреоидные гормоны представляют собой часть крупного комплекса тироглобулина, который запасается в клетках желез. После стимуляции секреции тироидного гормона протеолитические ферменты в фолликулярных клетках расщепляют запасенный тироглобулин, что приводит к освобождению гормонов Т3 и Т4, а также их последующему выделению в кровяное русло.
Катехоламины
Катехоламины — адреналин и норадреналин также образуются на основе тирозина, однако их синтез происходит в клетках мозгового слоя надпочечников. Ткань мозгового слоя надпочечников в действительности представляет собой модифицированный компонент симпатической части вегетативной нервной системы. Мозговая ткань надпочечников получает сигнал непосредственно от нервных окончаний симпатической нервной системы и представляет собой пример нейроэндокринной функции.
Образование катехоламинов происходит в хромаффиниых клетках мозгового слоя надпочечников путем многоэтапного биосинтеза. Сначала тирозин при участии тирозингидролазы превращается в 3,4-дигидроксифенилаланин (допа). Эта реакция является лимитирующей скорость процесса образования катехоламинов. Допа затем преобразуется в допамин, который в свою очередь превращается в норадреналин, основная масса последнего подвергается метилированию ферментом фенилэтаноламин-N-метилтрансферазой (PNMT) с образованием адреналина. Как адреналин, так и норадреналин являются катехоламинами, однако стахиометрическое соотношение этих соединений на этапе синтеза и выделения из надпочечников составляет 1 : 4. Несмотря на это, по содержанию в крови норадреналин превосходит адреналин, однако основная масса этого норадреналина продуцируется симпатической нервной системой, где он выполняет функцию нейротрансмиттера и оттуда попадает в кровь. Вместе с тем основным катехоламином, циркулирующим в системе кровообращения, является адреналин (Hedge et al., 1987).
После образования катехоламины могут накапливаться в клетках железы, где происходил их синтез, в виде хромаффинных гранул. Стимуляция симпатической нервной системы приводит к выделению катехоламинов путем типичного экзоцитоза и усилению активации тирозингидролазы, последнее приводит к увеличению продукции катехоламинов хромаффинными клетками и восстановлению внутриклеточных депо катехоламииов (Rhoades, Pflanzer, 2003).