Эндокринная регуляция репродуктивной системы
Источник:
Эндокриная система, спорт и двигательная активность.
Перевод с англ./под ред. У.Дж. Кремера и А.Д. Рогола. - Э64
Издательство: Олимп. литература, 2008 год.
Содержание
Эндокринная регуляция репродуктивной системы
Репродуктивная система мужчин и женщин в условиях интенсивной физической тренировки остается относительно стабильной. В то же время регулярное применение любого из многочисленных сильнодействующих веществ, относящихся к категории допинга, выполнение тренировочных программ с чрезмерной нагрузкой или не учитывающих принципа последовательного увеличения нагрузки, снижение массы тела в процессе тренировок, психосоциальный стресс, неадекватное восполнение энерготрат организма и постоянные значительные нагрузки в период полового созревания практически неизбежно влекут за собой изменения продукции репродуктивных гормонов. Применение анаболических стероидов приводит к нарушениям менструального цикла у женщин и уменьшению сперматогенеза у мужчин, а также существенному снижению концентрации защитного холестерина (липопротеиды высокой плотности) у представителей обоих полов. В отсутствие упомянутых выше факторов риска также могут наблюдаться менее значительные адаптационные изменения функции эндокринной системы и метаболизма, однако их влияние на состояние здоровья не установлено. Например, в одном из исследований долговременных эффектов двигательной активности было показано, что единственной заметной реакцией на тренировочный процесс, связанный с подготовкой к марафону молодых здоровых женщин, которые занимались бегом на длинные дистанции, было незначительное, в пределах естественных отклонений, сокращение продолжительности постовуляторной (лютеиновой) фазы менструального цикла. По данным исследований состояния репродуктивной функции, у спортсменов в целом был выявлен ряд нарушений, однако эти данные оказались обусловленными наличием некоторых известных патологических состояний. Таким образом, тренировочные занятия физическими упражнениями здоровых лиц зрелого возраста при условии контроля, соблюдения принципа постепенного увеличения нагрузки и применения обоснованной интенсивности нагрузки, а также адекватного восполнения энергозатрат, обладают минимальным потенциалом негативных воздействий на репродуктивную систему.
Введение
Критическая оценка влияния интенсивных тренировочных занятий и активного участия в спортивной деятельности на эндокринную систему является сравнительно недавним достижением медицинских исследований. В действительности большинство научных сообщений прошлых лет, которые цитируются в учебниках и на которые ссылаются рекламные листки современных биологических пищевых добавок, отличались тем, что непосредственный эффект физических нагрузок обычно смазывался наличием различных сочетанных факторов, из-за чего окончательные и безоговорочные выводы на основании полученных данных сделать было невозможно. Сегодня к научно обоснованным выводам можно предъявлять следующие требования (не исключая и других возможных): 1) участие в проведении исследований явно нормальных лиц без нарушений здоровья; 2) использование тренировочных программ, предусматривающих наличие контроля, постепенное увеличение нагрузки, а также возможность количественной оценки интенсивности и продолжительности занятий; 3) проведение в том же временном диапазоне параллельного исследования группы лиц с аналогичными характеристиками (возраст, пол), не принимающих участия в занятиях физическими упражнениями; 4) документально подтвержденную адекватность энергетической ценности рациона питания и энерготрат, связанных с двигательной активностью; 5) документально подтвержденное отсутствие применения скрытых лекарственных или гормональных препаратов (допинг); 6) исходная и последующая оценка испытываемого психосоциального стресса; 7) тщательный анализ семейного анамнеза, направленный на выявление наследственных факторов, которые используются при оценке вероятности нарушений функции репродуктивной системы у населения в целом. В настоящее время ни одно из проведенных исследований не удовлетворяет комплекс сформулированных требований, поэтому для понимания более тонких изменений метаболизма и функции эндокринной системы необходимо проведение дальнейших клинических и физиологических исследований.
Основы репродуктивной физиологии
Современные представления о репродуктивной физиологии человека охватывают комплексную картину обмена гормональными сигналами между центральной нервной системой (гипоталамус), передней долей гипофиза (гонадотропные клетки) и половыми железами (семенниками и яичниками). Упомянутый выше комплекс эндокринных желез (система эндокринной регуляции репродуктивной функции) управляется сигналами, связанными с половым созреванием, соматическим ростом, составом тела, реакцией на стресс, аппетитом, энерготратами организма и действием инсулина (Urban et al., 1988; Evans et al., 1992; Giustina, Vcldhuis, 1998). Для реконструкции патогенеза эндокринных нарушений и понимания отличительных особенностей механизмов нормальной адаптации к физическим нагрузкам необходимо рассматривать систему эндокринной регуляции репродуктивной функции комплексно. Так, для успешного функционирования репродуктивной системы в период интенсивных тренировок минимальным необходимым условием (обязательным, но не достаточным) является адекватное восполнение затраченной энергии (Loucks, 2003).
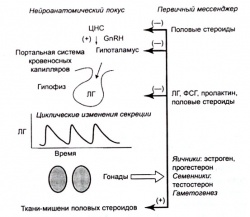
Сигналы, возникающие в центральной нервной системе и в периферических тканях, сходятся к гипоталамическому комплексу, сформированному примерно 1200 нейронами, которые секретируют гонадолиберин (GnRH-гонадотропин-рилизинг-гормон). Синхронное возбуждение этих нейронов приводит к циклическим выбросам гонадолиберина в портальную систему кровеносных капилляров (сплошные стрелки с [+]), соединяющую медиобазальный гипоталамус с гипофизом. Гонадолиберин управляет процессами транскрипции, трансляции, процессинга и секреции лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ) в гонадотропных клетках. Система кровообращения доставляет ЛГ к гонадам (семенникам или яичникам); ЛГ стимулирует синтез и секрецию тестостерона (и, следовательно, эстрадиола) у мужчин и женщин и прогестерона у женщин после овуляции. У женщин ФСГ способствует созреванию фолликулов (Граафовых пузырьков), готовности к оплодотворению ооцитов и повышению чувствительности яичников к ЛГ. У мужчин ФСГ оказывает действие, синергичное с тестостероном, секрецию которого внутри семенников стимулирует ЛГ, и стимулирует прохождение ранних стадий сперматогенеза в семенных канальцах. Половые стероиды воздействуют на периферические ткани-мишени, а именно мышечную и жировую ткани, молочные железы, скелет, кожные покровы, половые органы, гипоталамус и гипофиз. У женщин эстроген и прогестерон являются элементами регуляторной цепи обратной связи (подавление и стимуляция), их циклические колебания регулируют усиление секреции ЛГ, предшествующее овуляции. Те же половые гормоны стимулируют рост и созревание эндометрия матки, что необходимо для имплантации оплодотворенного бластоциста в беременности.
Адаптации эндокринной системы к физическим нагрузкам реализуются посредством нескольких уровней контроля: а) сигналы, поступающие в гипоталамус из ЦНС и с кровью; б) гипоталамическая интеграция поступивших сигналов и передача суммарного сигнала в переднюю долю гипофиза; в) система обратной связи, осуществляющая регуляцию активности гипоталамуса посредством внутренней температуры тела, медиаторов воспаления, продуктов тканевого обмена (лактат, свободные жирные кислоты и др.) и продуктов секреции клеток-мишеней (инсулиноподобный фактор роста стимулируется в печени соматотропином); г) экзогенные субстраты (глюкоза, жиры и аминокислоты); д) тиреоидные и надпочечниковые гормоны, обеспечивающие адаптацию к стрессу (тироксин, кортизол и адреналин). Эта минимальная сеть взаимодействий управляет гипоталамической стимуляцией гонадотропных клеток с помощью цикличного (волнообразного) выброса декапептида, гонадолиберина. Гонадолиберин индуцирует в гипофизе синтез и секрецию лютеинизирующего гормона (Л Г) и фолликулостимулирующий гормон (ФСГ). Эти два белка являются ключевыми эффекторами яичников и семенников. Амплитуда и периодичность секреции гонадолиберина определяют секретируемое в гипофизе количество ЛГ и ФСГ (Urban et al., 1988; Evans et al., 1992; Veldhuis, 1999): ЛГ регулирует синтез половых стероидных гормонов; ФСГ контролирует процессы образования спермы и созревания яйцеклеток, а также продукцию белка обратной связи — ингибина. Никаких значительных изменений в уровне секреции ФСГ и ингибина, связанных с занятиями физическими упражнениями, обнаружено не было (Veldhuis et al., 1998). Этот вывод справедлив и в отношении пролактина — гормона, стимулирующего лактацию, временное увеличение уровня которого наблюдается в ответ на тренировочные занятия и разнообразные психологические и физические стрессовые воздействия.
У мужчин ЛГ оказывает воздействие на клетки Лейдига в семенниках, стимулируя синтез и секрецию примерно 4 —бмг тестостерона ежедневно (Urban et al., 1988). У женщин ЛГ стимулирует в клетках оболочки яичников и желтого тела секрецию около 0,15 мг тестостерона (предшественника эстрогенов) и 10—20 мг прогестерона ежедневно (Evans et al., 1992). Тестостерон, эстроген и прогестерон обратимо подавляют (негативная обращая связь) гипоталамо-гипофизарный комплекс, осуществляя контроль цикличности секреции гонадолиберина, ЛГ и ФСГ (Veldhuis, 1999). Ограниченное во времени ингибирующее воздействие половых стероидных гормонов представляет собой фундаментальный регуляторный механизм, обеспечивающий поддержание репродуктивного гомеостаза. В целом гомеостаз является совокупным результатом обратных стимулирующих и подавляющих взаимодействий, которые обеспечивают циклические, обратимые изменения функции эндокринной системы, направленные на поддержание концентрации гормонов в пределах физиологической нормы, характерной для лиц данного возраста, пола и расы. Авторегуляцию здесь можно сравнить с системой автоматической регулировки оптимальной скорости автомобиля, которая удерживает скорость движения в заданном диапазоне. Таким образом, в организме здоровых людей каскад сигнальных взаимодействий обеспечивает необходимые для поддержания жизни концентрации субстратов (глюкоза), метаболитов (лактат) и гормонов (половые гормоны, кортизол, инсулин, соматотропин и др.). Необходимыми условиями поддержания гомеостаза являются детерминированные физиологические механизмы, низкий уровень случайных процессов, отсутствие генетических нарушений, адекватная психосоциальная поддержка и эффективная адаптация к внешним и внутренним стрессам (Veldhuis, 1996).
Гипоталамо-гипофизарно-гонадный гомеостаз при интенсивной физической тренировке
Долговременные клинические исследования
Несколько клинических исследований характеризуются проспективной рандомизацией выборки добровольцев без видимых нарушений здоровья, принимавших участие в занятиях физическими упражнениями различной интенсивности, продолжительности и/или тина. В одном долговременном исследовании молодые женщины с установившимся менструальным циклом принимали участие в тренировочных занятиях, интенсивность которых варьировала случайным образом от низкой (сублактатный порог) до высокой (супралактатный порог) (Rogol et al., 1992). Программа состояла в занятиях бегом на длинные дистанции, проходивших под руководством тренера, в течение 18 месяцев с индивидуальной целью пробежать марафонскую дистанцию. Содержание гормонов, регулирующих репродуктивную функцию, измеряли в начале исследований и спустя год занятий с постепенно увеличивающимся тренировочным объемом при заданной интенсивности занятий. Не обнаружено изменений содержания ЛГ, ФСГ, пролактина и эстралиола у лиц из группы, занимавшейся с низкой интенсивностью, а также у соответствующей контрольной группы женщин, которые вели активный образ жизни. У женщин, которые регулярно занимались с интенсивностью, превышающей индивидуально определенный лактатный порог, при равной протяженности общего пробега за время занятий (> 800 км), было установлено небольшое (1,8 суток) сокращение лютеиновой фазы менструального цикла при отсутствии заметных отличий в средней концентрации прогестерона (Rogol et al., 1992). Укорочение продолжительности лютеиновой фазы не превышало естественных колебаний этого показателя от цикла к циклу, наблюдавшихся у здоровых женщин предклимактерического возраста.
Значение адекватного восполнения энерготрат, связанных с двигательной активностью, демонстрирует одно из проведенных недавно исследований, основанных на использовании принципа проспективной рандомизации. В этом эксперименте продолжительностью 2 мсс у женщин, которые одновременно с выполнением физических нагрузок ограничивали калорийность своего рациона питания с целью снижения массы тела, вероятность нарушений продолжительности фолликулярной или лютеиновой фаз менструального цикла оказалась выше по сравнению с теми, кто занимался но такой же программе, но при этом не ограничивал энергетической ценности своего рациона (Buiten ct al.. 1985). Во всех случаях через 6 мсс после завершения этого исследования происходила нормализация менструального цикла.
Исследования по данным наблюдений
При определении содержания гормонов гипоталамо-гипофизарно-яичниковой системы у спортсменок вузов, занимавшихся бегом на длинные дистанции, была обнаружена группа лиц с нарушениями регулярных менструальных циклов, которые были предположительно обусловлены сниженной секрецией гипоталамического гонадолиберина (Rogol ct al., 1983; Veldhuis ct al., 1985; MacConnie et al., 1986). Вывод о сниженной секреции гонадолиберина в этих случаях был сделан на основании уменьшенной частоты периодических выбросов Л Г, притом что после инъекции синтетического гонадотропина наблюдалась нормальная или повышенная секреция гипофизарного ЛГ. Точных причин нарушения цикличности секреции ЛГ у отдельных спортсменок, занимавшихся бегом на длинные дистанции, не установлено. Эпидемиологические исследования показали, что обычно с этим явлением был ассоциирован один или несколько факторов риска нарушений репродуктивной функции.
При проведении проспективно рандомизированного анализа (wide infra) оказалось, что энергетический дефицит рациона питания при любом уровне энерготрат связан с повышенным риском олигоменореи (нарушение менструального цикла) (Bullen et al., 1985; Loucks, 2003). Несколько других обнаруженных клинических взаимосвязей, несмотря на отсутствие столь же четкой определенности, могут помочь в общих чертах выбрать направление для дальнейших исследований (Veldhuis et al., 1998).
Недостаточная энергетическая ценность рациона питания, неврогенная анорексия, булимия, анорексия отторгающего типа, принудительная рвота, а также чрезмерное применение слабительного — все эти факторы приводят к активации стресс-адаптивной гипоталамо-гипофизарно-надпочечниковой системы. Комплексный ответ на метаболический стресс центральной нервной системы включает ингибирование циклического характера секреции ЛГ путем подавления выделения гипоталамического гонадолиберина, которое в результате приводит к уменьшению стимуляции секреции ЛГ в передней доле гипофиза (Bergendahl et al., 1996, 2000; Loucks, 2003). Например, кратковременное голодание приводит к угнетению цикличного характера секреции ЛГ у здоровых лиц зрелого возраста. Исследования с участием молодых мужчин показали, что снижение концентрации ЛГ и тестостерона на 50 %, вызванное голоданием, может быть предотвращено периодическим внутривенным введением синтетического гонадолиберина каждые 90 мин (Aloi et al., 1997). Результат этого исследования демонстрирует, что недостаточная энергетическая ценность рациона питания ограничивает выделение гонадолиберина мозгом и таким образом блокирует секрецию ЛГ гипофизом.
Злоупотребления (применение без назначения врача) анаболических стероидов, синтетических прогестинов и соматотропного гормона человека (который оказывает пролактиноподобный подавляющий эффект на секрецию гонадолиберина) может стать причиной олиго- и аменореи (уменьшение продолжительности или нарушение менструальных циклов) у женщин, либо олиго- и азооспермии (уменьшение количества сперматозоидов или их отсутствие) у мужчин. Приводят ли к подобному результату инъекции эритропоэтина — неизвестно. Значительная психосоциальная нагрузка независимо от того, связан ли он с тренировочным процессом и участием в соревнованиях, также может приводить к нарушениям менструальной функции (Evans et al., 1992; Veldhuis et al., 1998). Кроме того, некоторые спортсмены начинают заниматься интенсивными тренировками с предсуществующими (недиагностированными) гормональными нарушениями и/или серьезными наследственными предпосылками к развитию эндокринных заболеваний. Оба эти фактора могут проявляться при воздействии значительной физической нагрузки или обнаруживаться независимо от двигательной активности.
Нерешенные проблемы
Важной нерешенной проблемой остается совместное действие двух или больше факторов, которые по отдельности увеличивают риск развития нарушений менструального цикла в условиях интенсивной физической тренировки. Этот вопрос решить чрезвычайно сложно, особенно учитывая практически безграничное количество возможных комбинаций различных факторов. Например, каким будет общий эффект от интенсивных занятий физическими упражнениями на менструальную функцию у женщины с наличием в семейном (но не персональном) анамнезе синдрома поликистоза яичников (обнаруживается у 5,0—8,5 % молодых женщин различной этнической принадлежности без признаков других заболеваний), периодическими нарушениями регулярности менструального цикла и незначительным снижением массы тела, связанным с тренировочными занятиями? И как на этот суммарный эффект может дополнительно повлиять выбор конкретного вида спорта, например спортивного фехтования, волейбола, прыжков с шестом, бега на 500 м или плавания на 100 м вольным стилем? Результаты наблюдений показывают, что нарушения менструального цикла реже всего встречаются у занимающихся велоспортом и плаванием (Evans et al., 1992). Непонятно также, в какой степени и в каких ситуациях факторы риска, характерные для женщин, будут применимы для мужчин? В настоящий момент данные, которые бы позволили решить все эти многофакторные задачи, отсутствуют. В действительности индивидуальные особенности, самостоятельные обращения к врачу, вид двигательной активности (и связанные с ним отклонения внутренней температуры тела), психологическая нагрузка, вероятность злоупотреблений лекарственными препаратами, потеря веса или его поддержание в пределах нормы, возраст начала тренировочных занятий и многие другие сопутствующие факторы, о которых ничего не известно, делают невозможной определенную интерпретацию данных исследований.
В отношении медицинского обслуживания профессиональных спортсменов врачи должны понимать, что физическая нагрузка сама по себе не может быть непосредственной причиной клинически значимых изменений функции эндокринной системы, следовательно, анализ особенностей питания, динамики изменений массы тела, энергетической ценности рациона питания, истории болезни, семейного анамнеза, симптомов системных нарушений и результатов медицинского скрининга, проведенный под руководством врача, поможет сохранить здоровье спортсмена. Для исключения вероятности либо обнаружения различных заболеваний, поддающихся лечению, необходимо проведение тщательной оценки состояния здоровья.
Исследованием влияния интенсивных физических тренировок на полноценность спермы, а также на плодовитость (способность зачать) или фертильность (способность выносить полноценного ребенка) женщины серьезно никто не занимался. К исследованиям, имеющим отношение к изучению данной проблемы, можно отнести долговременный, объективный контроль уровня ФСГ, ингибина и активина, фоллистатина, сперматогенеза, созревания Граафовых пузырьков, овуляции, лютеинизации (образования желтого тела), а также анализа плодовитости, фертильности и нормальных родов у женщин различного возраста. На основании таких многогранных наблюдений можно прогнозировать, что изменения детородной функции, обусловленные интенсивной физической нагрузкой, будут, скорее, незначительными, чем явно выраженными.
О влиянии, если таковое имеется, физических нагрузок на послеродовое состояние женщины также ничего не известно. К показательным параметрам, которые остаются неисследованными, можно отнести время, необходимое для восстановления менструального цикла после беременности, эффективность лактации, объем молока и его питательную ценность для новорожденного, а также взаимосвязь новорожденного с матерью.
Более глубокого осмысления требуют клинические аспекты относительно пренебрегаемой проблемы либидо, потенции и полового удовлетворения профессиональных спортсменов высокого уровня. Кроме того, заботой медиков должно быть предоставление всем спортсменам полного доступа к инструкциям и разъясняющим материалам, касающимся риска получения заболеваний, передаваемых половым путем, а также инфекционных респираторных и желудочно-кишечных заболеваний. Эта потребность обусловлена широким спектром социокультурных, диетических и географических условий, с которыми приходится сталкиваться спортсменам в связи с участием в международных соревнованиях.
Заключение
Интенсивные физические тренировки не приводят к существенным нарушениям репродуктивной функции у здоровых лиц зрелого возраста (это не обязательно относится к детям). Этот вывод неправомерен в ситуациях, когда физические тренировки сочетаются с недостаточной энергетической ценностью рациона питания, снижением массы тела, нарушениями нормального режима питания, сопутствующими заболеваниями, высоким риском развития наследственных заболеваний репродуктивной системы, чрезмерным психологическим стрессом и/или злоупотреблениями алкоголем, лекарственными или гормональными препаратами. Необходимы дополнительные медицинские исследования, направленные на выяснение других аспектов воздействия интенсивной физической нагрузки, в частности на плодовитость, фертильность, послеродовое восстановление и половую функцию.
Работа была выполнена при частичной финансовой поддержке Национального Института здоровья США и Государственного исследовательского центра (Бетесда, США), номера фантов RR00585, AG23133, DK60717.
Читайте также
Литература
- Aloi, J. A., Bergendahl. М., Iranmanesh, А. & Veldhuis, J.D. (1997) Pulsatile intravenous gonadotropin-releasing hormone administration averts fasting-induced hypogonadotropism and hypoandrogene-mia in healthy, normal-weight men. Journal of Clinical Endocrinology and Metabolism 82, 1543-1548.
- Bergendahl, М., Vance, M.L., Iranmanesh, A., Thorner, M.O. & Veldhuis, J.D. (1996) Fasting as a metabolic stress paradigm selectively amplifies cortisol secretory burst mass and delays the time of maximal nyctohemeral cortisol concentrations in healthy men. Journal oj Clinical Endocrinology and Metabolism 81(2), 692-699. Bergendahl, М., Iranmanesh, A., Pastor, C, Evans, W.S. & Veldhuis, J.D. (2000) Homeostatic joint amplification of pulsatile and 24-hour rhythmic cortisol secretion by fasting stress in midluteal phase women: concurrent disruption of cortisol-growth hormone, cortisol-luteinizing hormone, and cortisol-leptin synchrony. Journal of Clinical Endocrinology and Metabolism 85(11), 4028-4035.
- Bullen, B.A., Skrinar, G.S., Beitins, I.Z. et al. (1985) Induction of menstrual disorders by strenuous exercise in untrained women. Next England Journal of Medicine 312(21), 1349-1353.
- Evans, W.S., Sollenberger, M.J., Booth, Jr., R.A. et al. (1992) Contemporary aspects of discrete peak detection algorithms. II. The paradigm of the luteinizing hormone pulse signal in women. Endocrine Reviews 13(1), 81-104.
- Giustina, A. & Veldhuis, J.D. (1998) Pathophysiology of the neuroregulation of growth hormone secretion in experimental animals and the human. Endocrine Reviews 19(6), 717*797.
- Loucks, A.B. (2003) Energy availability, not body fatness, regulates reproductive function in women. Exercise and Sports Sciences Reviews 31(3), 144-148.
- MacConnie, S.E., Barkan, A.L., Lampman, R.M., Schork, M.A. & Beitins, I.Z. (1986) Decreased hypothalamic gonadotropin-releasing hormone secretion in male marathon runners. New England Journal of Medicine 315, 411-417.
- Rogol, A.D., Veldhuis, J.D., Williams, F.T. & Johnson, M.L. (1983) Pulsatile secretion of gonadotropins and prolactin in male marathon runners: relation to the endogenous opiate system. Journal of Andrology 5, 21-27.
- Rogol, A.D., Weltman, A., Weltman, J.Y. et al. (1992) Durability of the reproductive axis in eumenorrheic women during 1 year of endurance training. Journal of Applied Physiology 72(4), 1571* 1580.
- Urban, R.J., Evans, W.S., Rogol, A.D. et al. (1988) Contemporary aspects of discrete peak detection algorithms. I. The paradigm of the luteinizing hormone pulse signal in men. Endocrine Reviews 9, 3-37.
- Veldhuis, J.D. (1996) Neuroendocrine mechanisms mediating awakening of the gonadotropic axis in puberty. Pediatric Nephrology 10, 304-317.
- Veldhuis, J.D. (1999) Male hypothalamic-pituitary-gonadal axis. In: Reproductive Endocrinology (Yen, S.S.C., Jaffe, R.B. & Barbieri, R.L., eds.). W.B. Saunders Co., Philadelphia: 622-631.
- Veldhuis, J.D., Evans, W.S., Demers, L.M. et al. (1985) Altered neuroendocrine regulation of gonadotropin secretion in women distance runners. Journal of Clinical Endocrinology and Metabolism 61, 557-563.
- Veldhuis, J.D., Yoshida, K. & Iranmanesh, A. (1998) The effect of mental and metabolic stress on the female reproductive system and female reproductive hormones. In: Handbook of Stress Medicine: an Organ System Approach (Hubbard, J. & Workman, E.A., eds.). CRC Press, Boca Raton, FL: 115-140.