Метаболизм человека и эндокринная система
Категория:
«Фармакология».
Содержание
- 1 Общая физиология эндокринной и метаболической систем
- 2 Гипоталамо-гипофизарная система
- 3 ПАТОФИЗИОЛОГИЯ ЗАБОЛЕВАНИЙ ЭНДОКРИННОЙ И МЕТАБОЛИЧЕСКОЙ СИСТЕМ
- 4 Заболевания гипофиза
- 5 Отклонения в системе гормон роста — инсулиноподобный фактор роста
- 6 Нарушения углеводного обмена
- 7 Нарушения липидного обмена
- 8 Нарушения синтеза глюкокортикостероидов и других гормонов, вырабатываемых при стрессах
- 9 Минералокортикостероиды, вазопрессин и изменения объема циркулирующей крови
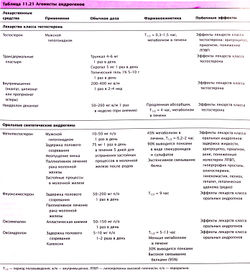
- 10 ЛЕКАРСТВА, ВЛИЯЮЩИЕ НА ЭНДОКРИННУЮ РЕГУЛЯЦИЮ РЕПРОДУКТИВНОЙ СИСТЕМЫ
- 11 Физиология женской репродуктивной системы
- 12 Заболевания, при лечении которых применяют эстрогены и антагонисты эстрогенов
- 13 Фармакология прогестерона
- 14 Контрацепция и менструация
- 14.1 Стероидные противозачаточные средства
- 14.2 Комбинированные оральные контрацептивы
- 14.3 Практика применения комбинированных оральных контрацептивов
- 14.4 Контрацептивы, содержащие только гестагены (минипили)
- 14.5 Депо-препараты гестагенов
- 14.6 Посткоитальные контрацептивы и экстренная контрацепция
- 15 Заместительная гормональная терапия
- 16 Нарушение выработки половых гормонов у женщин в период предменопаузы
- 17 Избыток андрогенов у женщин
- 18 Избыток и дефицит андрогенов у мужчин
- 19 Читайте также
- 20 Литература
Общая физиология эндокринной и метаболической систем
Эндокринная система состоит из желез внутренней секреции, выделяющих в кровь гормоны, которые регулируют функции тканей-мишеней. Эти железы включают гипоталамус, гипофиз, щитовидную и околощитовидные железы, панкреатические островки Лангерганса, надпочечники и половые железы (гонады). Эндокринная система регулирует семь основных физиологических функций (табл. 11.1). Главная цель лекарственной терапии эндокринных заболеваний — гармонизация взаимодействия между лекарствами, вводимыми экзогенно, и эндогенными гормонами.
Таблица 11.1 Функциональная анатомия эндокринной и метаболической систем
|
Эндокринная функция |
Регулирующие факторы |
Эндокринный орган/гормон |
Ткани-мишени |
|
Энергетический обмен |
Сывороточная глюкоза, аминокислоты, гормоны кишечника (соматостатин, холецистокинин, гастрин, секретин), вагусный рефлекс, симпатическая нервная система |
Панкреатические островки Лангерганса/инсулин, глюкагон |
Все ткани, прежде всего печень, скелетные мышцы, жировая ткань, косвенное воздействие на мозг и красные клетки крови |
|
Интенсивность обмена веществ |
Гипоталамический тиреотропин-рилизинг гормон (TRH), гипофизарный тиреотропный гормон (TSH) |
Щитовидная железа/ трийодтиронин (Т3) |
Все ткани |
|
Объем циркулирующей крови |
Ренин, ангиотензин II, гипоталамический осморецептор |
Гипофиз/вазопрессин |
Почки, кровяные сосуды, центральная нервная система |
|
Рост |
Гипоталамический гормон роста рилизинг гормона (GHRH), соматостатин, сон, физические упражнения, стресс, гипогликемия |
Гипофиз/гормон роста Печень/инсулиноподобные факторы роста (ICF) |
Все ткани |
|
Концентрация в сыворотке Са2+ и Мg2+ |
Паращитовидные железы/ паратиреоидные гормоны, кальцитонин, витамин D |
Почки, кишечник, кости | |
|
Репродуктивная функция |
Гипоталамический гонадотропин-рилизинг гормон (GnRH), гипофизарный фолликулостимулирующий гормон (FSH) и лютеинизирующий гормон (LH), ингибины |
Гонады/половые стероиды Надпочечники/андрогены |
Репродуктивные органы, центральная нервная система, различные ткани |
|
Гипоталамический кортикотропин-рилизинг гормон (CRH), гипофизарный адренокортикотропный гормон (АСТН), гипогликемия, стресс |
Надпочечники/ глюкокортикостероиды, эпинефрин |
ЦНС, печень, скелетные мышцы, жировые ткани, лимфоциты, фибробласты, сердечно-сосудистая система | |
|
Эндокринная и метаболическая системы регулируют семь основных функций организма. Для оказания эффекта на ткани-мишени эндокринные железы высвобождают гормоны в ответ на различные регулирующие факторы, в том числе физиологические (например, сон и стресс), биохимические (например, глюкоза и Са2+) и гормональные стимулы (например, гипоталамические гормоны). ЦНС — центральная нервная система. | |||
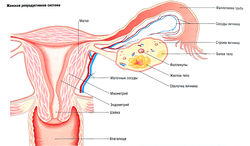
Эндокринное регулирование гомеостаза Са2+ обсуждается в главе 15, а расстройства циркуляторного объема — в главе 13. Дополнительная информация о нарушениях мочеполовой системы приведена в Мочеполовая система.
Гипоталамо-гипофизарная система
Гипоталамус и гипофиз интегрируют физиологические сигналы и высвобождают гормоны, регулирующие деятельность других желез
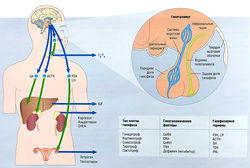
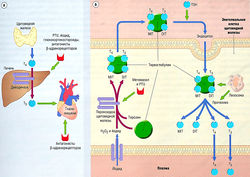
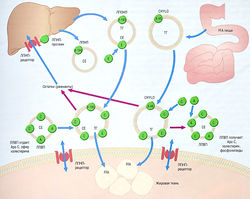
Рис. 11.1 Гипоталамо-гипофизарная система. Клетки передней доли гипофиза регулируются гипоталамическими гормонами, которые экскретируются в вены, идущие от гипоталамуса к передней доле гипофиза через стебель гипофиза. Гормоны передней доли гипофиза экскретируются в нижние каменистые вены для доставки эндокринным органам во всем теле. Задняя доля гипофиза состоит из специализированных нейронов, синтезирующих пептидные гормоны, вазопрессин и окситоцин, для экскреции в кровообращение большого круга. АСТН — адренокортикотропный гормон; CRH — кортикотропин-рилизинг гормон; DHEA — дегидроэпиандростерон; FSH — фолликулостимулирующий гормон; СН — гормон роста; CHRH — гормон роста рилизинг гормона; GnRH — гонадотропин-рилизинг гормон; IGF — инсулиноподобный фактор роста; LH — лютеинизирующий гормон; PRL — пролактин; Т3 — трийодтиронин; Т4 — тетрайодтиронин; TRH тиреотропин-рилизинг гормон; TSH — тиреотропный гормон.
Гипофиз в основном регулирует всю эндокринную систему (за исключением энергетического и электролитного обмена): работу щитовидной железы, глюкортикостероидов, половых стероидов и секрецию фактора роста путем синтезирования и выделения особых гормонов. Гипофиз состоит из передней доли и задней доли, в которых вырабатываются два гормона (пролактин и вазопрессин), действующие непосредственно на ткани-мишени (рис. 11.1). Передняя доля гипофиза (аденогипофиз) образована из дивертикула Ратке в зародышевой части глотки, а задняя доля (нейрогипофиз) — это внечерепные нейрональные ткани из промежуточного мозга. Кровоснабжение передней доли гипофиза идет по капиллярному ложу гипоталамуса, затем по проводящим венам к капиллярному ложу гипофиза. Такая система воротной вены обеспечивает доставку гипоталамических гормонов, регулирующих функцию передней доли гипофиза. В результате низкого перфузионного давления в системе воротной вены передняя доля гипофиза уязвима в отношении ишемии, особенно во время послеродового кровотечения (синдром Шихана). Передняя доля гипофиза состоит из различных типов клеток, вырабатывающих разные пептидные гормоны.
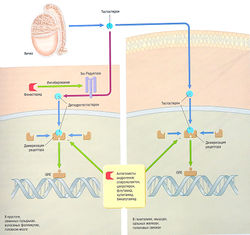
Рис. 11.2 Гипоталамо-гипофизарно-щитовидная система, (а) Регулирование обмена гормонов щитовидной железы иллюстрирует основные черты регуляции эндокринной системы гипоталамусом и гипофизом. Гипоталамический тиреотропин-рилизинг гормон (TRH), поступающий в кровообращение, стимулирует выработку гипофизом тиреотропного гормона (TSH). Циркулирующий TSH стимулирует высвобождение тироксина (тетрайодтиронин, Т4) и трийодтиронина (Т3) щитовидной железой из запасов в тиреоидных (щитовидных) фолликулах, (б) Лиганд-связанный рецептор щитовидной железы может димеризироваться или связываться с рецептором ретиноевой кислоты (RxR) перед транслокацией в ядро. Связанные рецепторы гормона щитовидной железы (TR) взаимодействуют со специальными элементами ответа на тиреоидные гормоны (TRE) чувствительных к этим гормонам генов. Гипоталамус и гипофиз также содержат рецепторы тиреоидных гормонов, которые обеспечивают ингибирование обратной связи циркуляцией тиреоидного гормона в крови. Тиреоидный гормон (гормон щитовидной железы) накапливается в фолликулах щитовидной железы. TSH стимулирует эндоцитоз запасов тиреоглобулина и высвобождает гормон щитовидной железы в кровь. Амебоподобные выросты фолликулов щитовидной железы захватывают тиреоглобулин внутрь клеток. TBG —тироксинсвязывающий глобулин.
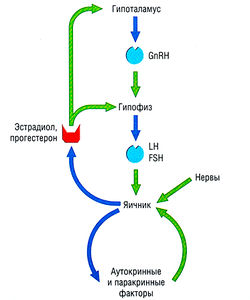
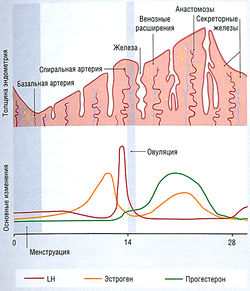
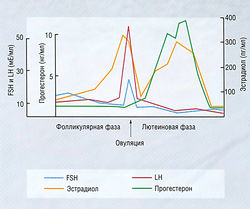
Регулирование секреции гормонов щитовидной железы — типичный пример контрольной петли гипоталамо-гипофизарной системы (рис. 11.2). Если гипоталамические рецепторы, чувствительные к гормону щитовидной железы, обнаруживают в крови низкую концентрацию циркулирующего гормона щитовидной железы, это приводит к высвобождению тиреотропин-рилизинг гормона (TRH) из гипоталамуса (третичный уровень регуляции) в систему воротной вены, снабжающей переднюю долю гипофиза. Стимулирование рецепторов TRH на клетках гипофиза ведет к высвобождению тиреотропного гормона (TSH) в венозную систему (вторичный уровень регуляции). TSH стимулирует высвобождение тиреоидных гормонов из щитовидной железы (первичный уровень продукции гормона). Гормон щитовидной железы действует непосредственно на ткани-мишени и имеет эффекты отрицательной обратной связи в отношении гипоталамуса и гипофиза. Системы, регулирующие выработку половых гормонов и глюкокортикостероидов, построены по четырех ступенчатому принципу: гипоталамус — гипофиз — конечная эндокринная железа — ткань-мишень.
Разные отделы эндокринной системы имеют общие признаки заболеваний
Эндокринные факторы, регулирующие интенсивность обмена веществ (тиреоидные гормоны), репродуктивную функцию (половые стероиды), адаптацию к физиологическому стрессу (глюкокортикостероиды) и рост тела (инсулиноподобный фактор роста), имеют общие признаки патологии, влияющие на уровень эндокринного обмена. Заболевание может порождать подобный эффект на любом уровне в регулирующей системе (т.е. гипо- или гиперстимуляцию органа-мишени), поэтому конкретные подходы к лекарственной терапии выбирают в зависимости от места патологии. Например, недоразвитие половой системы из-за неправильной работы гипофизных гонадотрофов хорошо поддается лечению с помощью поступающих извне гонадотропинов, но при гонадной недостаточности такое лечение будет неэффективным. При диагностике эндокринных заболеваний стараются определить место возникновения патологии путем идентификации гормональных реакций, характерных для разных болезней. Понимание первичных изменений и компенсаторных реакций на регулирующие гормоны, сопровождающих различные типы эндокринных заболеваний, необходимо для правильной диагностики и адекватного лечения.
ПАТОФИЗИОЛОГИЯ ЗАБОЛЕВАНИЙ ЭНДОКРИННОЙ И МЕТАБОЛИЧЕСКОЙ СИСТЕМ
Фармакологические принципы
Лекарства, влияющие на эндокринную и метаболическую системы, могут действовать на любом этапе процесса гормональной регуляции, где будут стимулировать или подавлять функции тканей-мишеней. Это обусловливает различные фармакотерапевтические подходы к достижению одинакового фармакологического эффекта путем модификации действия гормона или изменения его синтеза. Фармакологическое воздействие может быть нескольких видов: заместительная гормональная терапия, гормоноподавляющая терапия и использование других препаратов, влияющих на эндокринную систему. При заместительной гормональной терапии иногда используют синтетические аналоги эндогенного гормона.
Лекарственные средства, уменьшающие гормональную стимуляцию тканей-мишеней, могут увеличивать синтез гормонов за счет обратной связи с гипоталамусом и гипофизом. Например, ингибитор синтеза кортизола метирапон уменьшает глюкокортикостероидное угнетение высвобождения адренокортикотропного гормона. Применение этого препарата ведет к усилению стимуляции АСТН в надпочечниках, что может перевесить эффект от терапии метирапоном.
Заболевания гипофиза
Патология гипоталамуса и гипофиза может приводить к появлению симптомов, напоминающих патологию первичных эндокринных желез. Существенная роль гипофиза в регуляции многих функций эндокринной системы означает, что заболевания гипофиза могут привести к его гипо-или гиперфункции и повлиять на многие функции организма.
Гипофункция гипофиза
Причиной гипофункции гипофиза (гипопитуитаризма) могут быть деструктивные новообразования, опухоли, травмы, сосудистые инфаркты, воспалительные заболевания или гранулематозные инфекции гипофиза (табл. 11.2). Кроме того, в гипоталамо-гипофизарной системе синтеза отдельных гормонов может возникнуть специфический дефицит, приводящий к гипопитуитаризму. Главные признаки гипопитуитаризма: (1) гипофункция нескольких эндокринно-зависимых тканей-мишеней; (2) низкая концентрация первичных гормонов, отражающаяся на этих тканях; (3) концентрации гормонов гипофиза ниже уровня, обычно вызывающего компенсаторный эффект при гормональной недостаточности. В некоторых случаях концентрации гипофизных гормонов могут увеличиваться, но не настолько, чтобы полностью скорректировать гормональный дефицит. Терапия гипофункции гипофиза заключается в замещении гормонами щитовидной железы, половыми стероидами, глюкокортикостероидами, вазопрессином, а в некоторых случаях — гормоном роста.
Таблица 11.2 Причины гипопитуитаризма
|
Опухоли |
Гипофизарные опухоли |
|
Краниофарингиома | |
|
Менингиома | |
|
Инфаркт |
Послеродовой некроз гипофиза (синдром Шихана) |
|
Воспалительные/ инфильтративные болезни |
Саркоидоз |
|
Гистиоцитоз X | |
|
Гемохроматоз | |
|
Лимфоцитарный гипофизит | |
|
Инфекционные заболевания |
Туберкулез |
|
Сифилис | |
|
Физические повреждения |
Травма |
|
Операция | |
|
Облучение |
Гиперфункция гипофиза
ИЗБЫТОК ПРОЛАКТИНА (ГИПЕРПРОЛАКТИНЕМИЯ). Избыточная секреция гипофизом пролактина встречается довольно часто и имеет различные причины. Выработка пролактина подавляется дофамином, высвобождаемым гипоталамусом. Дофамин активирует расположенные в лактотрофах передней доли гипофиза D2-рецепторы, вследствие этого уменьшается синтез цАМФ. Избыточный пролактин обычно вырабатывается при наличии секреторной лактотрофной аденомы или других различных гипоталамо-гипофизарных причин, уменьшающих подавление дофамина (табл. 11.3). Избыток пролактина — частая причина бесплодия и галактореи. Если это связано с размером опухоли гипофиза, могут появиться другие симптомы, например головная боль или нарушения зрения из-за сжатия оптического нерва.
Таблица 11.3 Причины гиперпролактинемии
- Сдавление стебля гипофиза новообразованиями
- Лактотрофная аденома гипофиза
- Физиологические раздражители
- Кормление грудью
- Гормональное состояние
- Беременность
- Эстрогенная терапия
- Гипотиреоз
- Лекарственные средства
- Антипсихотические(антагонисты дофамина)
- Циметидин
- Верапамил
- Опиаты
- Почечная недостаточность и цирроз печени
- Травма грудной клетки
Выработка пролактина (даже из аденом гипофиза) подавляется агонистами D2рецепторов
Агонисты D2-рецепторов подавляют выработку пролактина (табл. 11.4). Препараты производят из спорыньи, они являются прототипом бромокриптина, который эффективен при снижении концентрации пролактина, но плохо переносится из-за вызываемых им тошноты и слабости. Возникают также редкие, но опасные для жизни осложнения: судороги, нарушения ритма сердца и мозгового кровообращения. Новейший агонист D2-рецепторов длительного действия каберголин имеет меньше побочных эффектов, чем бромокриптин. Кроме снижения пролактина, агонисты D2рецепторов также уменьшают лактотрофную аденому гипофиза, подавляя синтез ДНК и деление клеток. Во многих случаях уменьшение опухоли происходит уже через несколько дней после начала лечения. Нормализация пролактина достигается у 70-80% пациентов, получающих агонисты D2-рецепторов, в то время как хирургическое вмешательство успешно только в 50-60% случаев микроаденомы гипофиза. По этой причине для такого рода опухолей гипофиза в качестве основного метода лечения применяют агонисты D2-рецепторов вместо оперативного вмешательства. Терапевтический эффект также включает устранение вызываемых гипогонадизмом аменореи, бесплодия и потери костной ткани.
Таблица 11.4 Дофаминовые агонисты, применяемые при лечении гиперпролактинемии
Дофаминергические агенты, снижающие уровень пролактина
- Тошнота и рвота
- Артериальная ортостатическая гипертензия
- Насморк
- Обострение психоза
- Спазм сосудов пальцев
Отклонения в системе гормон роста — инсулиноподобный фактор роста
Избыток гормона роста (акромегалия)
Система гормон роста (GH) — инсулиноподобный фактор роста — эндокринная система, патологии которой преимущественно касаются гипофиза и гипоталамуса. Гормон роста, 191-аминокислотный пептид, способствует синтезу белка и росту тканей. Многие эффекты гормона роста осуществляются посредством IGF, синтезируемых в печени. IGF — это пептидные гормоны, оказывающие анаболическое действие путем стимуляции рецепторов, связанных с тирозинкиназой. Избыточная выработка гормона роста встречается редко и обычно связана с соматотропной аденомой гипофиза. Избыток GH во взрослом возрасте (акромегалия) обычно не приводит к увеличению роста. Основные признаки избытка GH у взрослых: грубые черты лица (рис. 11.3, табл. 11.5), увеличение кистей рук и ступней ног, внутренних органов, например сердца (кардиомегалия), и толщины мягких тканей. У детей избыток GH может привести к гигантизму.
Иногда показано лечение новообразований, вырабатывающих гормон роста, дофаминергическими агонистами или октреотидом
Лечение новообразований, вырабатывающих гормон роста, обычно проводят хирургическими методами и лучевой терапией. При необходимости можно применять два класса лекарственных средств:
- дофаминергические агонисты D2-рецептора, подавляющие выработку гормона роста в некоторых случаях;
Таблица 11.5 Симптомы акромегалии
- Грубые черты лица
- Увеличение кистей рук и ступней
- Утолщение мягких тканей
- Нарушения расположения зубов
- Артралгии
- Избыточное потоотделение
- Непереносимость глюкозы
- Увеличение внутренних органов (например, сердца)
- Гипертензия
- Обвисание кожи
- аналоги соматостатина (например, октреотид или лантреотид).
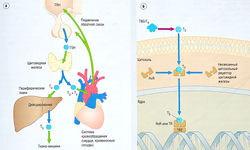
Соматостатин — 14-аминокислотный пептидный гормон, вырабатываемый различными органами, включая центральную нервную систему, пищеварительный тракт, панкреатические 5-клетки. Соматостатин подавляет высвобождение целого ряда гормонов (рис. 11.4). G-белок-связанные рецепторы соматостатина подавляют высвобождение гормона, уменьшая уровень цАМФ. Соматостатин не разрабатывали как лекарственное средство, но его синтетический октапептидный аналог октреотид применяют для лечения акромегалии, карциноидных новообразований и кишечной дисфункции.
Рис. 11.4 Физиология соматостатина. Соматостатин синтезируется в гипоталамусе, панкреатических 5-клетках (а) и желудочно-кишечном тракте (б). Соматостатин подавляет клеточные процессы, относящиеся к выработке гормона роста (СН), инсулина, глюкагона и кишечных гормонов путем уменьшения накапливания циклического аденозинмонофосфата (цАМФ) и подавления клеточной деполяризации. CHRH — гормон роста рилизинг гормона; IGF-1 — инсулиноподобный фактор роста 1.
При лечении акромегалии у большинства больных октреотид применяют в стартовой дозе 0,05 мг 3 раза в день. Далее не следует превышать максимальную дозу, составляющую 0,5 мг 3 раза в день. Если после 3 мес лечения не отмечается достаточного снижения гормона роста и улучшения клинической картины заболевания, терапию следует прекратить. После достижения максимального терапевтического эффекта можно переводить пациента на более удобную схему лечения октреотидом-SAR — 20 мг внутримышечно 1 раз в месяц. Лечение октреотидом нормализует выработку гормона роста и концентрацию IGF-1 примерно у 50-80% больных акромегалией. Аналог соматостатина длительного действия эффективен в 60-75% случаях. Терапевтическая реакция на эти лекарства включает уменьшение артралгий, потливости, головных болей, апноэ во сне, улучшение сердечной функции. Побочные эффекты: болезненность в месте инъекции, изменения в функционировании кишечника, увеличение риска желчнокаменной болезни.
Дефицит гормона роста
В клинической практике довольно часто встречаются жалобы пациентов на маленький рост, но он очень редко связан с дефицитом GH (табл. 11.6). Дефицит роста может возникнуть вследствие пангипопитуитаризма (пангипопитуитарной карликовости), избирательного повреждения гипофизарных соматотрофов или недостаточности образования гипоталамического гормона роста рилизинг гормона.
Человеческий гормон роста (hGH), получаемый из трупных экстрактов гипофиза, применяли в прошлом, но это в некоторых случаях приводило к возникновению болезни Крейтцфельдта-Якоба. Сейчас для лечения дефицита гормона роста в педиатрии, маленького роста из-за синдрома Тернера и дефицита гормона роста у взрослых применяют рекомбинантный человеческий гормон роста (rhGH) соматотропин и близкий hGH аналог соматрем. Соматрем содержит 191 аминокислоту природного hGH и дополнительный остаток метионина. Гормон роста связывается с рецепторами GH во многих тканях, которые активируют внутриклеточные проводящие пути тирозинкиназы. В печени активация рецептора GH приводит к выработке IGF-1 и IGF-2, которые являются мономерными протеинами, высокогомологичными инсулину. IGF связывает IGF-рецепторы во многих тканях и стимулирует сигнальные проводящие пути тирозинкиназы.
Таблица 11.6 Причины маленького роста
- Конституциональный маленький рост
- Наследственный (генетический) маленький рост
- Хроническое заболевание
- Задержка внутриутробного развития
- Психосоциальный нанизм
- Эндокринные состояния
- Гипопитуитаризм
- Недостаток гормона роста
- Резистентность к гормону роста
- Гипотиреоз
- Избыток глюкокортикостероидов
- Нарушения обмена витамина D
- Генетические синдромы
- Ахондроплазия
- Синдром Тернера
- Синдром Нунана
- Наследственное ожирение
Рекомбинантный hGH ускоряет линейный рост скелетных костей, оказывает анаболический эффект на органы и мягкие ткани, активизирует задержку электролитов и усиливает мобилизацию глюкозы и жирных кислот. Эндогенная выработка гормона роста имеет прерывистый, пульсирующий характер, поэтому постоянный уровень экзогенного GH в плазме не является необходимым условием для терапевтического эффекта и введение hGH с определенными перерывами приводит к длительному увеличению концентрации IGF-1 в плазме. Т1/2 из плазмы рекомбинантного гормона роста составляет примерно 4 час после подкожного введения детям в обычной дневной дозе (0,18— 0,3 мг/кг в неделю, разделенная на 6 дневных доз). Т1/2 соматотропина составляет 20 мин, но клиренс в плазме после подкожной инъекции увеличен из-за отложенной абсорбции.
Лечение детей с дефицитом гормона роста приводит к достижению среднего роста во взрослом возрасте в пределах 0,5-0,7 стандартных отклонений от обычного среднего роста. Лечение пациентов с синдромом Тернера приводит к увеличению роста у взрослого на 6-7 см. При лечении детей побочные эффекты hGH встречаются редко, и отсутствуют данные о повышении риска возникновения диабета или рака. Терапию hGH у детей прерывают на время закрытия зоны роста эпифизов костей. Лечение взрослых с дефицитом гормона роста ведет к умеренным улучшениям двигательных способностей, субъективных симптомов, росту мышечной массы и снижению жировых отложений, но долгосрочное улучшение состояния здоровья полностью не достигается. Терапия гормоном роста может обострить непереносимость глюкозы у взрослых. Введение гормона роста взрослым в критических состояниях в попытке обратить катаболизм тканей приводило к неожиданному повышению смертности. Применение гормона роста в качестве допинга стало популярно среди спортсменов из-за анаболического воздействия на мышцы. Поскольку этот гормон является рекомбинантным человеческим гормоном, очень трудно обнаружить незаконное применение соматотропина при анализе на применение лекарственных средств.
Гормоны щитовидной железы контролируют метаболическую деятельность всех тканей путем регуляции генов, белковые продукты которых влияют на клеточное дыхание
Многие ткани отвечают на гормональную и паракринную стимуляцию активацией клеточного метаболизма. Например, скелетные мышцы отвечают на непрерывную стимуляцию активацией миозин-АТФазы и последующим увеличением уровня глюкозы и поддержанием сокращения мышц. Независимо от типа тканей и функционально-ориентированной регуляции клеточного метаболизма гормоны щитовидной железы регулируют клеточный метаболизм и синтез белка. Эти процессы обычно определяют как обмен веществ. Гормоны щитовидной железы оказывают множественные эффекты (табл. 11.7), являющиеся проявлением процесса регулирования общего уровня метаболизма и энергозатрат клеток тела.
Такие факторы, как голодание или тяжелая болезнь, сокращают активность гормонов щитовидной железы и консервируют энергозатраты во многих тканях, и наоборот, в условиях возбуждения ЦНС, например состоянии страха или беспокойства, гипоталамо-гипофизарно-щитовидная система стимулируется. Гормоны щитовидной железы в целом не являются компонентами гормональной реакции на стресс из-за замедленности их действия, однако они являются дополнительным фактором при длительной стрессовой ситуации.
Таблица 11.7 Физиологические эффекты гормонов щитовидной железы
- Развитие плода (физическое и умственное)
- Скорость обмена веществ
- Температура тела
- Частота и сила сердечных сокращений
- Расширение периферических сосудов
- Количество циркулирующих эритроцитов
- Дыхание
- Периферическая нервная система (рефлексы)
- Метаболические ферменты печени
- Обмен костной ткани
- Влияние на кожу и мягкие ткани
Синтез, высвобождение и действие гормонов щитовидной железы на органы-мишени — многоступенчатый процесс, некоторые из этих ступеней — места действия лекарств
Активный гормон щитовидной железы трийодтиронин (Т3) и его предшественник тироксин, или тетрайодтиронин (Т4), формируются в дополнение к анионам Г на двух ароматических кольцах остатков тирозина на большом пептиде в щитовидной железе. Для йодирования тирозина и объединения двух йодтирозиновых молекул при образовании тиронина в эпителиальных клетках щитовидной железы необходимы три фактора:
- способность накапливать высокие межклеточные концентрации I-активным транспортом;
- действие окисляющего энзима, трийодпероксидазы, катализирующего связывание гипойодата (IO~) с тирозиновым кольцом, и связывание двух йодированных молекул тирозина;
- наличие крупного полипептидного тиреоглобулина со множественными тирозиновыми остатками, подходящими для йодирования (рис. 11.5).
Рис. 11.5 Фармакология гормонов щитовидной железы, (а) Тироксин (тетрайодтиронин, Т4) претерпевает дейодирование до три-йодтиронина (Т3) путем дейодирования на периферии, например в печени. Показаны места действия антитиреоидных средств. (6) Йодид активно доставляется в клетки щитовидной железы. Пероксидаза щитовидной железы, микросомальный энзим, катализирует йодирование ароматических колец тирозина в позициях 3 и 5, создавая монойодтирозин (MIT) и дийодтирозин (DIT). Пероксидаза щитовидной железы преобразовывает остатки тиронина в тиреоглобулине. Тиреоглобулин вырабатывается и накапливается в фолликулах щитовидной железы. Тиреотропный гормон (TSH) заставляет депонированный тиреоглобулин пройти эндоцитоз и лизосомальный протеолиз для высвобождения гормонов щитовидной железы, в то время как йодид ингибирует высвобождение. PTU — пропилтиоурацил.
Иодированный тиронин хранится во внеклеточных тиреоидных фолликулах. Он высвобождается в кровь как гормон щитовидной железы после эндоцитоза фолликулярными клетками щитовидной железы. В тиреоидных фолликулах хранится тиреоидный прегормон, обычно в достаточных количествах, чтобы поддерживать высвобождение Т4 в течение примерно 6 нед. Т3 имеет в 10 раз большее сродство к тиреоидному рецептору, чем Т4, поэтому Т3 считают активной формой гормона. Хотя некоторое количество Т3 высвобождается из щитовидной железы, основная его часть формируется путем дейодирования Т4 энзимов дейодиназы. Изоформы энзимов дейодиназы в гипофизе (тип II) и на периферии (тип I) регулируются дифференцированно. При системном заболевании или голодании активность изоформ типа I сокращается, в то время как тип II сохраняется. Этот механизм приводит к сокращению периферических метаболических потребностей, предотвращая компенсаторное увеличение высвобождения TSH.
Гипотиреоз
Недостаток гормона щитовидной железы — часто встречающееся расстройство, обычно вызываемое аутоиммунным разрушением щитовидной железы. Симптомы гипотиреоза: увеличение массы тела, непереносимость холода, сухость кожи, интеллектуальная заторможенность. В самом тяжелом варианте (при микседеме) может развиться кома. У новорожденных гипотиреоз может стать причиной пожизненной умственной недостаточности (кретинизма) и неправильного развития костной системы.
Первичный сбой в работе щитовидной железы вследствие аутоиммунного заболевания — тиреоидит Хашимото. Это самая частая причина гипотиреоза, хотя могут быть и другие причины, например воспалительные заболевания и травмы (табл. 11.8). Аутоиммунные заболевания щитовидной железы, как и многие другие аутоиммунные болезни, чаще встречаются у женщин. В редких случаях могут ассоциироваться с другими аутоиммунными эндокринными дефицитами, такими как недостаточность надпочечников, инсулинозависимый сахарный диабет или гипогонадизм. Ослабленное действие гормонов щитовидной железы может быть также вызвано пониженной выработкой TSH гипофизом (вторичный гипотиреоз) или, в редких случаях, клеточной резистентностью тканей к гормонам щитовидной железы.
Синтетические тиреоидные гормоны широко применяют для лечения гипотиреоза
Синтетический левотироксин (I-Т4) — удобная активная форма заместительной гормональной терапии для приема внутрь. Хотя левотироксин требует метаболической активации для превращения в Т3, его широко применяют из-за длительного периода полувыведения — 6 дней. Это пролонгированное действие обусловлено в основном экстенсивным связыванием с тиреоидным глобулином плазмы и с преальбумином, что ведет к сокращенному клиренсу и депонированию циркулирующего лекарственного средства. Препараты с длительным периодом полувыведения обычно используют при лечении хронических заболеваний, т.к. влияние пропуска одной дозы на стабильную концентрацию в плазме невелико. Недостатком лечения с помощью I-Т4 является значительный срок, необходимый для достижения стабильного эффекта. Адекватность дозы можно оценить только после лечения в течение 5 нед. Лиотиронин (натрий I-трийодтиронин) менее активно связывается с глобулином щитовидной железы, поэтому несвязанная доля этого лекарства выше, чем у I-Т4. Лиотиронин действует быстрее, чем I-Т4, но и быстрее выводится, что обусловливает прием препарата 2 раза в день.
Таблица 11.8 Причины гипотиреоза
|
Первичный |
Хронический лимфоцитарный тиреоидит (болезнь Хашимото) Подострый тиреоидит Безболезненный тиреоидит (послеродовой тиреоидит) Прием радиоактивного йода Избыток или дефицит йода Врожденное нарушение синтеза гормона щитовидной железы |
|
Вторичный |
Заболевания гипофиза |
|
Ткани-мишени |
Резистентность к гормонам щитовидной железы |
Начальная доза I-Т4 для большинства взрослых составляет 75-150 мкг/сут (1,7 мкг/кг/сут), симптоматическое улучшение наблюдается уже через 4 нед. Начальная доза I-Т4 для детей — 1 мкг/кг/сут. Передозировка увеличивает риск фибрилляции предсердий. Ускоренный обмен веществ может также ухудшить течение стенокардии, хотя нормальная заместительная гормональная терапия не повышает склонность к тромбозу. По этой причине у пожилых больных гипотиреоз лечат I-Т4, начиная с дозы 25 мкг/сут и увеличивая ее на 25 мкг/сут с 4-недельными интервалами при надлежащем наблюдении.
Гипертиреоз
Гипертиреоз — это синдром усиления тканевого обмена гормонами щитовидной железы вследствие их избыточной секреции или приема экзогенного гормона.
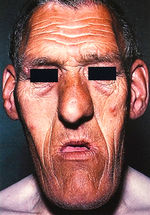
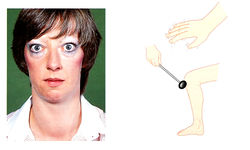
Избыток гормонов щитовидной железы обычно возникает вследствие стимулируемого их высвобождения или при наличии аденомы щитовиднои железы, вырабатывающей гормоны (табл. 11.9). Часто причиной является аутоиммунное заболевание (болезнь Грейвса). При болезни Грейвса антитела активируют TSH-рецепторы, приводя к диффузному увеличению щитовидной железы, избыточному высвобождению гормона и классическим признакам гипертиреоза — нервозности, потере массы тела, тремору, ретракции век, потоотделению, непереносимости тепла (рис. 11.6). Другие формы гипертиреоза также включают эти признаки, но только при болезни Грейвса иммунологически поражаются глазные мышцы, приводя к экзофтальму (выступанию глазного яблока) или проптозу. Другие иммунологические формы тиреоидита также могут привести к избыточной выработке гормонов, вызывая «утечку» прегормонов через воспаленную щитовидную железу.
Рис. 11.6 Признаки гипертиреоза. Гипертиреоз характеризуется нервозностью, потерей массы тела, непереносимостью жары, усталостью. Такие признаки, как тахикардия, тремор, ускоренные рефлексы, гладкость кожи, гипергидроз, возникают при гипертиреозе любой этиологии. Проптоз, диплопия и корнеальное воспаление характерны для болезни Грейвса (предоставлено C.D. Forbes, W.F. Jackson).
Таблица 11.9 Причины гипертиреоза
- Прием гормонов щитовидной железы
- Диффузный токсический зоб (болезнь Грейвса)
- Гиперфункционирующая аденома
- Токсический многоузловой зоб
- Безболезненный тиреоидит
- Подострый тиреоидит
- Аденома, вырабатывающая тиреотропный гормон
- Опухоли, вырабатывающие человеческий хорионический гонадотропин
Основные причины неиммунологически опосредованного гипертиреоза — аденомы, как одиночные, так и множественные (многоузловой зоб). Множественные аденомы часто встречаются в пожилом возрасте и обычно клинически выражены слабо. Иногда секреция гормона щитовидной железой и высвобождение его из аденомы превышает суточную потребность, что и ведет к гипертиреозу.
Антитиреоидные лекарственные средства подавляют синтез гормона, его высвобождение, метаболизм и влияние на ткани-мишени
Препараты, применяемые для лечения гипертиреоза, действуют на всех этапах синтеза и высвобождения гормонов (см. рис. 11.5).
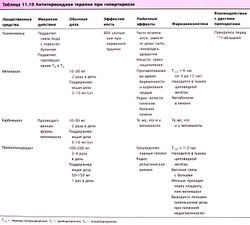
Молекулярное действие метимазола и пропилтиоурацила (табл. 11.10) — угнетение образования и депонирования гормонов щитовидной железы. При наличии запасов ранее синтезированного гормона снижение выработки тироксина может наблюдаться только через несколько недель. Пропилтиоурацил подавляет реакцию дейодинации, при которой происходит синтез активного Т3 из Т4. Этот механизм используют при лечении тяжелого гипертиреоза. Метимазол имеет длительный период полувыведения, что позволяет применять препарат 1-2 раза в день. Оба лекарства токсичны для печени и могут вызвать аллергическую реакцию и угнетение костного мозга, поэтому их применение требует постоянного клинического наблюдения.
Иодид (I), содержащийся в пищевых добавках, радиофармацевтические препараты и некоторые микстуры от кашля также могут снизить высвобождение гормонов щитовидной железы. Кроме того, I- угнетает переход Т4 в Т3. При остром тиреотоксикозе, связанном с болезнью Грейвса, введение I (например, в форме перенасыщенного йодида калия, раствора Люголя, или оральный прием рентгеноконтрастного вещества) — наиболее быстрый способ подавляющего лечения из всех существующих.
Антагонисты β-адреноцептора (пропранолол или эсмолол) часто применяют для противодействия избытку гормонов щитовидной железы. Эта форма функционального (физиологического) антагонизма (см. главу 3) возникает вследствие того, что некоторые эффекты гормонов щитовидной железы и эффекты стимуляции β-адренорецепторов одинаковы (тахикардия, интенсификация обмена веществ, нервозность, тремор). Таким образом, действие гормонов щитовидной железы и адреностимуляторов может быть аддитивным или даже синергическим. Гормоны щитовидной железы увеличивают количество адренорецепторов во многих тканях.
Антитиреоидная лекарственна, терапия
- Пропилтиоурацил и метимазол подавляют синтез гормонов щитовидной железы
- I блокирует высвобождение накопленного гормона щитовидной железы
- I и пропилтиоурацил подавляют преобразование Т4 в Т3
- Антагонисты β-адренорецепторов функционально противодействуют эффектам гормонов щитовидной железы на органы-мишени
Нарушения углеводного обмена
Гормоны щитовидной железы регулируют основные показатели обмена веществ, при этом их влияние на поставку энергии в клетки минимально. За эту функцию отвечает поджелудочная железа. В отличие от всех остальных эндокринных систем, регуляция эндокринной части поджелудочной железы идет не через гипоталамо-гипофизарную систему. Углеводный и жировой обмен регулируется следующим образом:
- сигналами, поступающими из пищеварительного канала (растяжение желудка, состав пищи);
- сигналами, поступающими из кровеносной системы (уровень циркулирующей глюкозы);
- внутриклеточными сигналами (внутриклеточные запасы энергии).
Общая гомеостатическая функция углеводного и жирового обмена — поставка энергии для использования, депонирования и мобилизации запасов энергии во время голода.
Регулирование обмена углеводов и жирных кислот — ключевая функция инсулина и ассоциированных гормонов. Поддержание адекватного уровня глюкозы в крови особенно важно для мозга и скелетных мышц.
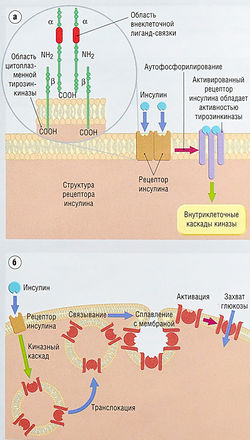
Стимуляция инсулиновых рецепторов активирует транспорт глюкозы на клеточных мембранах инсулин-чувствительных тканей
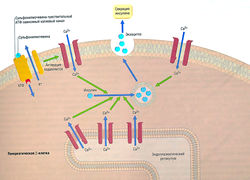
Внутриклеточные механизмы действия инсулина еще до конца не выяснены. Инсулиновые рецепторы расположены на мембранах клеток-мишеней и связаны с тирозинкиназой (рис. 11.7). Фосфорилирование внутриклеточных киназ изменяет их энзимную активность, приводя к последовательным фосфорилирующим и дефосфорилирующим этапам во внутриклеточной сигнальной цепи. Стимуляция инсулиновых рецепторов ведет к транслокации транспортеров глюкозы из мест эндосомально-го хранения к мембране клетки и к увеличению поглощения глюкозы. Упорядочивание транспортеров глюкозы в тканях-мишенях важно для панкреатических β-клеток, регулирующих выработку инсулина для глюкозо-чувствительных механизмов.
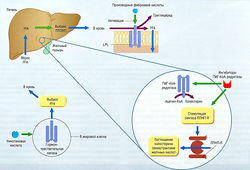
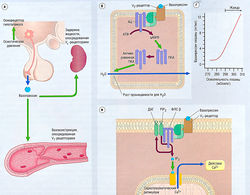
Рис. 11.7 Действие инсулина, (а) Рецептор инсулина — гетероди-мерический трансмембранный рецептор, состоящий из двух а- и двух (3-субьединиц. Внутриклеточные части бета-субъединиц содержат тирозинкиназу. Возбуждение инсулинового рецептора приводит к фосфорилированию внутриклеточных сигнальных молекул. Фосфорилирование остатков тирозинкиназы приводит к активации каскадов серин/треонин киназы, (б) Внутриклеточные каскады киназы вызывают перемещение транспортеров глюкозы от эндосомального пространства до плазменной мембраны, где они увеличивают поглощение глюкозы.
Рис. 11.8 Выработка инсулина. Секреция инсулина в панкреатических р-клетках стимулируется высвобождением Са2+ из эндоплазма-тической части потенциал-чувствительных каналов, а также притоком внеклеточного Са2+. АТФ-зависимый К+-канал на плазменной мембране поддерживает внутриклеточный потенциал покоя. Блокада К+-канала сульфонилмочевиной или меглитинидами приводит к деполяризации и активации Са2+-канала и в итоге к повышенной секреции. АТФ — аденозинтрифосфат.
Высвобождение инсулина происходит в ответ на такие стимулы, как глюкоза, аминокислоты, гормоны, вырабатываемые в желудочно-кишечном тракте. Эти стимулы ведут к деполяризации β-клеток в панкреатических островках Лангерганса и Са2+-опосредованному экзоцитозу инсулина в воротную вену (рис. 11.8). Потенциал мембраны β-клеток регулируется АТФ-чувствительными калиевыми каналами (1к(атф)), являющимися мишенью для сульфонамидных гипогликемических средств. Максимально высокая концентрация инсулина — в печени, перед попаданием в системный кровоток.
Инсулин оказывает различные эффекты на энергетический метаболизм (табл. 11.11), а общий эффект координирует распределение глюкозы, синтез и накопление гликогена и белков. Различные эффекты на метаболизм обусловлены концентрацией.
Подавление формирования кетоновых тел в печени происходит при более низких концентрациях инсулина, чем стимуляция поглощения глюкозы в скелетных мышцах.
Таблица 11.11 Действие инсулина на энергетический обмен
|
Углеводы |
Увеличивает транспорт глюкозы Увеличивает синтез гликогена Увеличивает гликолиз Подавляет гликонеогенез |
|
Жиры |
Повышает активность липопротеинлипазы Повышает накопление жира в адипоцитах Подавляет липолиз (гормон-чувствительной липазой) Увеличивает синтез липопротеина в печени Подавляет перекисное окисление липидов |
|
Белки |
Увеличивает синтез белка Увеличивает транспорт аминокислот |
Система гормонов поджелудочной железы, гипофиза и надпочечников защищает от гипогликемии
При голодании по мере уменьшения концентрации глюкозы в крови происходит подавление высвобождения инсулина. Если концентрация глюкозы в плазме падает ниже критического уровня, начинаются множественные нейрогормональные изменения:
- высвобождение поджелудочного глюкагона;
- активация симпатической нервной системы;
- гипоталамо-гипофизарно-надпочечниковое высвобождение гормона роста, кортизола и эпинефрина.
Эти регуляторные процессы увеличивают гликогенолиз и подавляют высвобождение инсулина. Симптомы гипогликемии (нервозность, тахикардия, дрожь, потоотделение) появляются в результате активности симпатической нервной системы. Отсутствие регулирования, как это наблюдается при избытке инсулина и пангипопитуитаризме, приводит к недостаточному уровню глюкозы в головном мозге, что ведет к коме. Соматостатин, синтезируемый в панкреатических 5-клетках, подавляет высвобождение как инсулина, так и иных регулирующих гликемию гормонов.
Сахарный диабет
Свое название сахарный диабет получил из-за присутствия глюкозы в моче при этом заболевании. Известны два основных типа сахарного диабета, которые имеют сходное течение гипергликемии и сосудистых осложнений. Они отличаются по патогенезу и способности остаточного инсулина подавлять формирование кетонных тел из жирных кислот (табл. 11.12).
Сахарный диабет I типа (инсулинозависимый, со склонностью к кетоацидозу) возникает вследствие аутоиммунного разрушения панкреатических (3-клеток. Аутоиммунный процесс начинается за несколько лет до прекращения выработки инсулина, и к моменту диагностики сахарного диабета большинство (3-клеток уже безвозвратно повреждены. Поскольку это обычно происходит до 30 лет, этот тип сахарного диабета называют юношеским диабетом. Главная особенность диабета I типа — неспособность поджелудочной железы вырабатывать даже небольшое количество инсулина, требуемое для подавления формирования кетонов, что приводит к рецидивам диабетического кетоацидоза.
При сахарном диабете II типа инсулин вырабатывается, но он неэффективен для нормализации уровня глюкозы в плазме крови. Однако количество имеющегося инсулина в большинстве случаев достаточно для подавления образования кетонов, поэтому у таких пациентов нет рецидивирующих приступов диабетического кетоацидоза. Инсулин иногда назначают и таким пациентам, но обычно для предотвращения кетоацидоза он им не нужен. Функция β-клеток при диабете II типа со временем снижается до такой степени, что у некоторых пациентов развивается дефицит инсулина, а при инфекционном или другом серьезном заболевании может развиться кетоацидоз. На ранней стадии диабета II типа главная особенность этого заболевания — неадекватное изменение уровня глюкозы крови в ответ на введение инсулина. Это явление получило название «инсулинорезистентность». Она возникает из-за мутации рецептора, ослабляющей его реакцию на инсулин. Диабет II типа и резистентность к инсулину обусловливают синдром, который может включать:
- дефекты транспорта глюкозы;
- денсенситизацию инсулиновых рецепторов;
- токсические эффекты гипергликемии;
- нарушения обмена веществ, ведущие к повышению массы тела;
- состояния, связанные с избытком контр-инсулярных гормонов (например, феохромоцитома, синдром Кушинга и акромегалия);
- состояния, связанные с утратой панкреатической функции (например, хирургическое удаление раковых образований на железе или самой железы).
Признаки гипергликемии характерны для всех типов диабета
К гипергликемии приводит дефицит инсулина (I тип) или инсулинорезистентность (II тип). Нарушение усвоения глюкозы тканями-мишенями после приема пищи ведет к постпрандиальной (возникающей после еды) гипергликемии, однако основная причина диабетической гипергликемии — недостаточное подавление гликонеогенеза инсулином. Концентрации глюкозы в плазме натощак более 7 ммоль/л (125 мг/дл) связаны с повышенным риском долгосрочных диабетических осложнений (см. далее). Симптоматическая гипергликемия (полиурия, полидипсия, потеря массы тела) обычно встречается при высоких уровнях глюкозы в крови. Гликозурия возникает только при концентрации глюкозы в почечных канальцах выше порога максимального поглощения, который наступает приблизительно при 9 ммоль/л (160 мг/дл). По этой причине контроль глюкозы в моче не всегда может быть критерием эффективности антидиабетической терапии.
|
Таблица 11.12 Различия инсулинозависимого и инсулинонезависимого сахарного диабета | ||
|
ИЗСД (1 тип) |
ИНЗСД (II тип) | |
|
Возраст начала заболевания |
< 30 лет |
> 30 лет |
|
Семейный анамнез сахарного диабета |
Редко |
Часто |
|
Масса тела |
Без ожирения |
Ожирение |
|
Кетоацидоз |
Часто |
Редко |
|
Необходимость инсулинотерапии |
Все пациенты |
Некоторые пациенты |
|
Наличие других аутоиммунных эндокринных состояний недостаточности |
Да (редко) |
Нет |
|
Распространенность у взрослых |
0,5% |
5% |
|
HLA-ассоциации |
Да |
Нет |
ИЗСД — инсулинозависимый сахарный диабет; ИНЗСД — инсулинонезависимый сахарный диабет.
Повышение концентрации глюкозы в плазме крови увеличивает уровень гликозирования (неферментативного ковалентного соединения глюкозы) многих белков в организме. Повышенный уровень гликолизированного гемоглобина (НbА1с) отражает наличие длительной гипергликемии и при диабете полезен для гликемического контроля.
Резистентность к инсулину может встречаться при отсутствии гипергликемии
Сильная инсулинорезистентность ведет к нарушению регуляции глюкозы и развитию сахарного диабета, но у многих пациентов с гипертензией и гиперхолестеринемией инсулинорезистентность не сопровождается нарушением регуляции глюкозы. Термином «синдром X» обозначают сочетание гипертензии, гиперхолестеринемии и инсулинорези-стентности. Такие пациенты составляют большую часть группы риска из-за опасности преждевременного атеросклероза. Патогенез этого синдрома неизвестен, но нарушение действия инсулина связывают с увеличенной выработкой печеночного липопротеина очень низкой плотности (ЛПОНП) и снижением концентрации циркулирующего липопротеина высокой плотности (ЛПВП) (см. далее), что увеличивает риск атеросклероза.
Оба типа сахарного диабета сопровождаются ангиопатиями и нейропатиями, которые ведут к поражению органов
Два типа диабета различаются по этиологии, обмену кетонов и роли инсулинорезистентности, но оба приводят к сходным патологическим последствиям. Так называемые осложнения органов-мишеней включают болезни сетчатки глаза, почечную недостаточность, дисфункцию периферических нервов, периферических сосудов и атеросклероз. Сахарный диабет II типа встречается в 9 раз чаще, чем диабет I типа, у взрослых с ожирением. Диабет — основная причина слепоты и почечной недостаточности и главная причина заболеваемости и смертности из-за атеросклероза, приводящего к цереброваскулярному тромбозу, инфаркту миокарда, ампутации конечностей.
Терапия сахарного диабета инсулином
Для подбора дозы инсулина применяют различные препараты инсулина с разными схемами абсорбции
Перед тем как в 1930-е гг. открыли и стали применять инсулин, диабет I типа был фатальным заболеванием в детском возрасте. Разнообразие препаратов инсулина обеспечивает физиологическую схему его замещения (табл. 11.13). Инсулиновый насос с прикрепленной к нему маленькой подкожной иглой, поставляющий основную часть инсулина и маленькие болюсы перед едой, является самым успешным способом воспроизведения физиологической секреции инсулина. Однако этот метод не обеспечивает лучший контроль глюкозы, чем у пациентов, точно соблюдающих инъекционную схему введения инсулина. Успешность режима многократных инъекций зависит от наличия инсулинов с различными фармакокинетическими характеристиками. Продолжительность действия разных инсулинов (см. далее) различна, т.к. гипогликемический ответ на каждый тип инсулина индивидуален у разных пациентов, что требует постоянного контроля.
Инсулины короткого действия (стандартные) применяют для быстрой доставки инсулина в связи с приемом пищи. Большинство стандартных инсулинов — это человеческий инсулин, произведенный по технологии рекомбинантной ДНК, но имеется и полусинтетический стандартный инсулин из свиного инсулина. Стандартный инсулин состоит из суспензии цинк-инсулина, но не имеет иных добавок для задержки всасывания. Инсулины короткого действия формируют димерические или гекзамерические агрегаты для замедления абсорбции. Абсорбция из подкожной клетчатки идет медленнее, чем из поджелудочной железы, поэтому такие препараты вводят за 30-45 мин до еды, а действуют они в течение 6 часов.
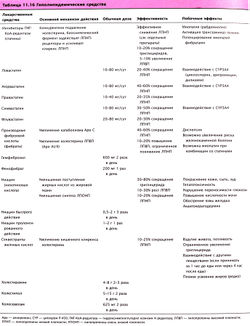
Таблица 11.13 Препараты инсулина
|
Лекарственные средства |
Начало действия |
Пиковое действие (час) |
Продолжительность действия (час) |
|
Регуляр |
Быстрое |
1-3 |
5-7 |
|
Семиленте |
Быстрое |
3-4 |
10-16 |
|
Нейтральный протамин |
Средняя скорость |
6-14 |
18-28 |
|
Хагедорна | |||
|
Ленте |
Средняя скорость |
6-14 |
18-28 |
|
Ультраленте |
Длительное |
18-24 |
30-40 |
Инсулины среднего и длительного действия начинают и заканчивают действовать более плавно. Это достигается путем использования буфера, меняющего растворимость инсулина (ленте), или дополнением катион-активного белкового протамина (нейтрального протамина Хагедорна, NPH) к стандартной суспензии цинк-инсулина. В зависимости от состава и происхождения инсулина (человеческий, свиной или коровий) инсулины среднего действия начинают действовать примерно через 2 час, пик наступает через 10 час, окончание действия — через 20 час.
Инсулин длительного действия (ультраленте) содержит цинковый и ацетатный буфер для более длительной задержки абсорбции. Его действие начинается через 4 час, заканчивается — через 36 час. Гларгин — аналог инсулина, который абсорбируется более 24 час без выраженного абсорбционного пика. Гларгин отличается от рекомбинантного человеческого инсулина заменой аргинина глицином в 21-й аминокислоте и добавкой двух остатков аргинина к С-концу цепи В. В отличие от ультраленте, гларгин начинает действовать в течение 1 час после инъекции. Это обеспечивает адекватные основные концентрации инсулина путем единственной ежедневной инъекции.
Инсулины лизпро и аспарт — это генетически спроектированные рекомбинантные аналоги инсулина, которые не подвергаются непосредственной димеризации. Эти мономерные инсулины абсорбируются быстрее стандартного инсулина и имеют меньший период до начала и меньшую длительность действия, поэтому их вводят непосредственно перед приемом пищи. Из-за короткого времени действия мономерные аналоги инсулина приводят к меньшей гипогликемии, чем стандартный инсулин.
Схемы инсулинотерапии обычно включают сочетания инсулинов короткого или быстрого действия с инсулинами среднего или длительного действия для обеспечения максимального эффекта во время гепатического неогенезиса утром и днем во время еды, но минимального эффекта натощак. Для терапии диабета I типа нужен небольшой временной промежуток между введениями инсулина и приемом пищи, поэтому обычно комбинируют инсулин стандартной и средней длительности действия.
Некоторые пациенты с диабетом II типа, у которых сохранилась только остаточная функция β-клеток, для улучшения гликемического контроля нуждаются в инсулине среднего или длительного действия. Введение инсулина определяется временем и режимом питания, но утреннее увеличение активности гипоталамо-гипофизарно-надпочечниковых гормонов типа кортизола и эпинефрина может увеличить уровень глюкозы в крови даже без приема пищи. Этот утренний феномен системы ГГН и медленный уровень абсорбции инсулина средней длительности действия позволяет абсорбировать такой инсулин во время сна с минимальной ночной гипогликемией.
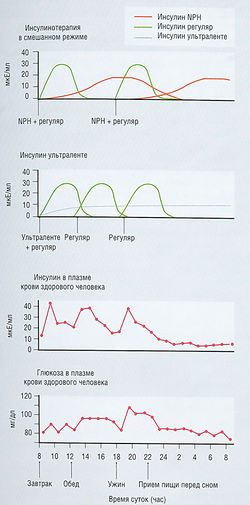
Цель инсулинотерапии диабета I типа — имитировать физиологическое действие эндогенного инсулина
Для воспроизведения нормальной функции поджелудочной железы больные диабетом I типа нуждаются в низких уровнях инсулина во время сна, более высоких уровнях инсулина в период с утра до ночи и значительного увеличения уровня быстродействующего инсулина во время приема пищи (рис. 11.9). Первые две цели могут быть достигнуты введением инсулина среднего действия (NPH, ленте) или длительного действия (ультраленте) 2 раза в день, идеально — вечером и утром. Вечернюю дозу инсулина длительного действия выбирают таким образом, чтобы достичь нормогликемии перед завтраком без ночной гипогликемии. При достижении нормогликемии перед завтраком утреннюю дозу инсулина длительного действия регулируют так, чтобы добиться нормогликемии перед вечерним приемом пищи. Гларгин позволяет выполнить оба эти условия путем однократного введения. Короткодействующие (стандартные или мономерные) аналоги инсулина нужно вводить с каждым приемом пищи для достижения уровня глюкозы в крови менее 9 ммоль/л (160 мг/дл) в течение 2 час после приема пищи. При изменениях в режиме питания и физической нагрузки дозу короткодействующего инсулина корректируют в зависимости от уровня глюкозы в крови перед приемом пищи.
Рис. 11.9 Инсулинотерапия. Уровни инсулина в крови после введения различных препаратов инсулина по сравнению с уровнями инсулина и глюкозы у здорового человека. Вводимый инсулин не компенсирует связанные с приемом пищи нарушения выброса инсулина панкреатическими железами из-за удаленности места введения. Цель введения препаратов инсулина состоит в координации пика поставки инсулина с режимом питания. Системные уровни инсулина при инсулинотерапии сахарного диабета I типа выше, чем при эндогенном панкреатическом регулировании. Панкреатический выброс инсулина в систему воротной вены может подавить гликонеогенез в печени при более низких дозах, чем необходимо при системном введении инсулина. NPH — нейтральный протамин Хагедорна.
Трудности, связанные с дневным введением инсулина, можно решить путем использования утром инсулина средней длительности действия (вместо инсулина длительного действия) и регулированием времени приема пищи.
Уровень глюкозы в крови поздним вечером должен быть в диапазоне между 5,5 и 7,7 ммоль/л (100 и 140 мг/дл соответственно), но нужно неоднократно его проверять у пациентов ночью в 2 час после любого изменения режима инсулинотерапии.
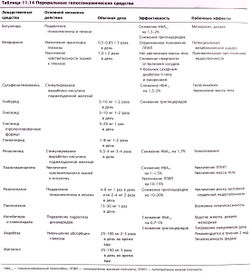
Пероральные гипогликемические средства
Цель пероральной гипогликемической терапии состоит в увеличении секреции инсулина или повышении чувствительности тканей к эндогенному инсулину. Пероральные препараты используют для терапии пациентов с сахарным диабетом, которым не нужно введение инсулина для предотвращения гипергликемии и кетоацидоза (табл. 11.14).
Производные сульфонилмочевины и меглитиниды повышают функцию β-клеток, блокируя АТФ-зависимые К+-каналы (1к(атф)) в клетках поджелудочной железы. В результате они вызывают деполяризацию, активирующую потенциал-зависимые Са2+-каналы, увеличивая внутриклеточные концентрации Са2+, который, в свою очередь, повышает выброс инсулина в кровь.
Антидиабетический эффект сульфонилмочевины обнаружили случайно. Было замечено, что антимикробные средства сульфонамидной группы иногда вызывают гипогликемию. Препараты сульфонилмочевины двух поколений сходны по своему действию и безопасности, но различны по дозам и частоте введения (см. табл. 11.14). Препараты сульфонилмочевины первого поколения (толбутамид, хлорпропамид, ацетогексамид и толазамид) требуют более высоких дозировок, но имеют такую же эффективность, как и препараты сульфонилмочевины второго поколения. Препараты второго поколения активируются из неактивных форм в печени, следовательно, при их приеме риск гипогликемии для пациентов со сниженной функцией почек меньше, чем при приеме средств, выводимых почками, например хлорпропамида. Хотя глипизид и глибурид отличаются Т1/2 в плазме (3 час и 10 час соответственно), но оба имеют одинаковую эффективность единичной ежедневной дозы. У этих препаратов нет тесной корреляции концентраций в плазме с уровнем снижения глюкозы.
Репаглинид — недавно появившийся препарат не из группы сульфонилмочевинов, блокирующий 1К(атф) и, возможно, другие мишени панкреатических β-клеток. Репаглинид быстро всасывается, его T1/2 составляет приблизительно 1 час. Он метаболизируется CYP3A4 и выводится с калом. Репаглинид принимают за 15-30 мин до еды, его эффект снижения уровня глюкозы сходен с действием препаратов сульфонилмочевины.
Пероральные средства для лечения инсулинонезависимого диабета
- Препараты сульфонилмочевины стимулируют выпуск инсулина подавлением К+-каналов в панкреатических β-клетках
- Бигуаниды и троглидазол усиливают чувствительность к инсулину тканей-мишеней
- Все гипогликемические препараты усиливают секрецию и действие инсулина, уменьшая дисфункцию β-клеток и токсичность гипергликемии
Метформин — наиболее часто применяемый препарат из подгруппы бигуанидов. Бигуаниды — синтетические аналоги антидиабетических растительных препаратов, используемых в Южной Европе. Первый бигуанид (фенформин) вызывал серьезный лактат-ацидоз, поэтому препарат больше не применяют. Метформин не приводит к тяжелым формам этого побочного эффекта. Метформин увеличивает чувствительность к инсулину различных тканей, особенно печени, где под действием препарата уменьшается печеночный гликонеогенез (механизм этого эффекта пока не ясен). Т1/2 метформина составляет 6 час, препарат выводится исключительно почками. Из-за риска метаболического ацидоза метформин противопоказан пациентам с почечной недостаточностью, дисфункцией печени, застойной сердечной недостаточностью и при назначении рентгенологических обследований с контрастными веществами. Метформин имеет узкий терапевтический индекс, т.к. минимально эффективная доза для большинства пациентов — 1500 мг/сут, а максимальная — 1 г 2 раза в день или 850 мг 3 раза в день. Принимать метформин следует с пищей, контролировать его дозировку необходимо каждые 2 нед, начиная с низкой стартовой дозы (например, 500 мг 2 раза в день). Метформин имеет три преимущества перед другими пероральными средствами: (1) не вызывает увеличение массы тела; (2) не вызывает гипогликемию; (3) снижает риск микроангиопатий (почечных, ретинальных, нейрональных) и макроангиопатий (инфаркта миокарда). По этим причинам метформин является препаратом выбора для больных диабетом II типа и ожирением. Гипогликемическое действие метформина сходно с действием препаратов сульфонилмочевины, совместное использование бигуанидов с препаратами сульфонилмочевины может дать хороший эффект.
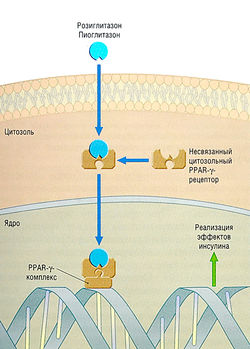
Тиазолидиндионы (TZD) — новый класс антидиабетических средств, которые действуют как агонисты рецепторов активации пролиферации пероксисом у-подкласса (PPAR-y). PPAR — это лиганд-активируемые факторы транскрипции, сходные с семейством тиреоидных и стероидных рецепторов. Поскольку эндогенный лиганд этих рецепторов пока неизвестен, их называют орфанными («сиротскими») рецепторами.
В настоящее время в клинической практике используют TZD (розиглитазон, пиоглитазон), вызывающие усиление действия инсулина на скелетные мышцы, жировые ткани и печень. Это приводит к увеличению доставки глюкозы в ткани и уменьшению гликонеогенеза в печени (рис. 11.10). Периоды полувыведения розиглитазона (3-4 час) и пиоглитазона (3-7 час) достаточно короткие, тем не менее их введение 1-2 раза в день оказывает необходимый терапевтический эффект. Для достижения стабильного фармакодинамического эффекта нужно несколько недель. Как лекарственное средство, понижающие уровень глюкозы, TZD менее эффективны, чем метформин или сульфаниламиды. К преимуществам TZD относятся легкость подбора дневной дозы, низкий гипогликемический потенциал и способность увеличивать холестерин ЛПВП. Результатов долгосрочных исследований влияния на сердечно-сосудистую систему пока нет, однако известно, что низкий уровень холестерина ЛПВП — это общая особенность дислипидемии и заболеваний коронарных артерий при диабете II типа. TZD могут вызывать увеличение массы тела и объема крови, что усиливает застойную сердечную недостаточность. Первый препарат этого класса (троглитазон) был снят с производства из-за токсичности для печени, но у лекарств, применяемых в настоящее время, гепатотоксичность не наблюдается.
Рис. 11.10 Скелетные мышцы, жировая ткань и печень. Триазолидиндионы поступают в цитозоль и связываются с PPAR-y-рецепторами. Комплекс входит в ядро и активирует ответный сигнал. Усилительный каскад приводит к увеличению чувствительности к инсулину. PPAR-y — рецепторы активации пролиферации пероксисом у-подкласса.
Ингибиторы кишечной а-глюкозидазы (акарбоза, митлиголь) обеспечивают альтернативную стратегию в лечении диабета II типа, уменьшая поглощение глюкозы. Ингибиторы а-глюкозидазы менее эффективны, чем другие пероральные препараты, но полезны для пациентов с преобладающей послеобеденной гипергликемией. Препараты принимают непосредственно перед едой, они выводятся кишечником без значительного системного всасывания. Из-за нарушенной абсорбции глюкозы и повышенной ее доставки в ободочную кишку ингибиторы кишечной а-глюкозидазы часто вызывают метеоризм и спастические боли в области желудка.
Больным диабетом II типа обычно нужен многократный прием лекарственных средств
У пациентов с диабетом II типа редко удается удовлетворительно контролировать уровень глюкозы натощак менее 8 ммоль/л (140 мг/дл) с помощью монотерапии метформином или препаратами сульфонилмочевины. Со временем гликемический контроль у таких пациентов ухудшается независимо от применяемого препарата. По этой причине может требоваться комбинированная терапия для максимального исключения ангиопатических диабетических осложнений, которые возникают при использовании одного нормогликемического средства. Практический подход к комбинированной терапии заключается в дополнении максимальной дозы инсулина пероральным препаратом. Лекарственные средства, которые не вызывают гипогликемию при монотерапии (например, метформин, TZD), могут вызвать ее при использовании вместе с препаратами сульфонилмочевины или инсулином.
В отличие от пероральных препаратов, инсулин можно непрерывно титровать в сторону увеличения, т.к. с течением времени гипергликемия прогрессирует и большинству больных диабетом II типа, возможно, потребуется инсулин.
Самый простой подход к инсулинотерапии — однократное введение на ночь инсулина длительного действия (например, в дозе 20 ЕД) и использование днем перорального препарата. Этот метод хорошо переносят пациенты, и он дает очень небольшое инсулин-связанное увеличение массы тела. Если гипергликемия сохраняется даже при дозе свыше 50 ЕД на ночь, нужно добавлять дневные инъекции инсулина. Больным диабетом с минимальной резистентностью необходимо 0,5-1,0 мкг/кг инсулина в день, в основном инсулина длительного или среднего действия. Но для большинства пациентов с диабетом II типа дозу нельзя предварительно рассчитать из-за переменного характера инсулинорезистентности.
Коррекция гликемии снижает риск осложнений со стороны органов-мишеней
Крупномасштабное проспективное исследование Diabetes Control and Complication Trial продемонстрировало, что поддержание нормогликемии с помощью диеты и нескольких инъекций инсулина в день снижает риск развития заболеваний сетчатки, нефропатии и периферической нейропатии при диабете I типа. Исследование United Kingdom Prospective Diabetes Study выявило преимущества контролируемой гликемии при диабете II типа. Тем не менее, поддержание нормогликемии труднодостижимо клинически, и необходимо разрабатывать другие формы лечения для снижения тяжести осложнений.
Из-за высокой вероятности поражения коронарных артерий и сосудов мозга при диабете осторожное лечение гипертензии и дислипидемии дает значительные клинические улучшения. У больных диабетом II типа с гипертензией гипотензивные средства классов ингибиторов ангиотензинпревра-щающих ферментов (АПФ) и β-блокаторов, по-видимому, одинаково эффективны в снижении смертности от инфаркта миокарда, инсульта и прогрессирования почечной недостаточности.
Доказано, что с помощью ингибиторов АПФ можно снизить почечную недостаточность при диабете I типа и прогрессирование протеинурии при диабете II типа независимо от наличия гипертензии. Ингибитор АПФ рамиприл также эффективен для предотвращения первичных заболеваний коронарных артерий при диабете независимо от наличия артериальной гипертензии. Известно, что гемфиброзил значительно снижает показатели инфаркта миокарда у мужчин с типичным для диабета низким уровнем ЛПВП. Ингибиторы ГМГ-КоА-редуктазы (статины) также эффективны для профилактики инфаркта миокарда при диабете.
Читайте также Пероральные сахаропонижающие средства
Гипогликемия
Гипогликемия — термин, применяемый для описания патологически низкого уровня глюкозы в крови и симптомов, сходных с вызываемыми контринсулярными гормонами
Наиболее верное определение патологической гипогликемии — недостаток адекватной дозы глюкозы в глюкозозависимых тканях (особенно в головном мозге). Гипогликемия приводит к нарушению умственной функции (нейрогликопении) и таким признакам контринсулярных ответов, как нервозность, тахикардия, сердцебиение, чувство голода, потоотделение и др. Патологическая гипогликемия встречается редко, обычно вследствие передозировки инсулина, реже — из-за опухолей, вырабатывающих инсулин или потребляющих глюкозу, совсем редко — из-за нарушений в системе пищеварения.
В прошлом гипогликемию часто диагностировали по наличию сахара в крови ниже нормального уровня натощак в пределах 3 час после приема внутрь глюкозы. В настоящее время известно, что такие постабсорбционные концентрации глюкозы могут быть низкими без ущерба для поставки энергии к глюкозочувствительным тканям.
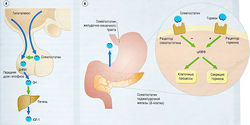
Многие психоневрологические жалобы были отнесены к гипогликемии в результате неправильного применения теста на переносимость перорального приема глюкозы. Патологическая гипогликемия может развиться вследствие разных причин, но классический признак — наличие инсулин-вырабатывающей опухоли поджелудочной железы (инсу-линомы). Диазоксид — препарат, сокращающий секрецию инсулина путем активации 1К(АТФ)-каналов (эффект, противоположный ингибирующему эффекту препаратов сульфонилмочевины на эти каналы) и, следовательно, гиперполяризации мембраны панкреатических β-клеток. Это состояние лечат в основном хирургическим путем, хотя при неоперабельных опухолях иногда используют терапию октреотидом или диазоксидом.
ГЛЮКАГОН. Природный контринсулярный гормон глюкагон вводят парентерально. Короткий период полувыведения ограничивает его использование при неотложной коррекции тяжелой гипогликемии. Тем не менее, пероральный прием глюкозы для пациентов в сознании — это первая помощь во время приступа гипогликемии.
Нарушения липидного обмена
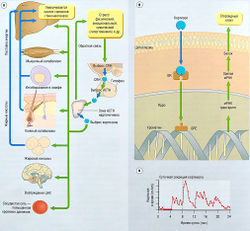
Поступающие с пищей и эндогенные липиды являются строительным материалом для функционально важных компонентов, например клеточных мембран, желчи, стероидных гормонов и межклеточных сигнальных молекул (простагландинов и лейкотриенов). Процессы потребления жиров с пищей, синтеза липидов в печени и их транспортировка в ткани интегрированы в белково-липидный метаболизм (рис. 11.11).
Рис. 11.11 Метаболизм липопротеинов. Поглощенные свободные жирные кислоты (FFA) преобразуются в триглицериды (ТГ), объединенные с апопротеином (Аро) В-48, и покрываются монослоем фосфолипидов для формирования хиломикронов (CHYLO) в кишечной лимфе. Точно так же триглицериды, синтезируемые в печени, объединяются с Аро В-100, формируя липопротеин очень низкой плотности (ЛПОНП) в печени. Эти богатые триглицеридом липопротеины получают белки Аро С от липопротеина высокой плотности (ЛПВП). Аро С является кофактором для липопротеинлипазы в сосудистом эндотелии, которая поставляет жирные кислоты тканям. Поскольку богатые триглицеридом частицы усвоены, ЛПВП возвращает Аро С и фосфолипиды для многократного использования вновь рождающимися частицами. Частицы захватываются печенью и выделяются в частицы липопротеинов низкой плотности (ЛПНП), содержащие эфиры холестерина (СЕ) как их основную составляющую.
Липопротеиновая система — источник триглицерида периферических тканей и регулятор обмена холестерина
Крупные липопротеиновые комплексы (кишечные хиломикроны) имеют самое высокое содержание триглицеридов и, соответственно, самую маленькую плотность. При транспорте через мембраны сосудов липопротеинлипаза удаляет триглицериды для их потребления тканями. Апопротеины (класс С) действуют как кофакторы липазы и обмениваются богатыми триглицеридом частицами и циркулирующим ЛПВП. Содержание триглицерида постепенно падает, а плотность увеличивается, поэтому липопротеины средней плотности (ЛПСП) и остатки хиломикронов постепенно захватываются механизмом поглощения в печени, распознающим аполипопротеины классов В и Е.
В дополнение к курсирующим к периферийным тканям триглицеридам, система липопротеина организует также транспорт холестерина. Печень синтезирует холестерин и липопротеины низкой плотности (ЛПНП) для поставки холестерина в ткани. Холестерин поглощается нуждающимися в нем тканями посредством белка ЛПНП, относящегося к АПНП-редепторам, а также нерецепторными механизмами. Дефекты АПНП-рецепторов приводят к наследственной гиперхолестеринемии, белково-липидным нарушениям, характеризующимся очень высокими уровнями холестерина, и преждевременному атеросклерозу.
Печень также синтезирует компоненты частиц ЛПВП, которые содержат аполипопротеины, способствующие этерификации холестерина и переходу к частицам, богатым триглицеридами. ЛПВП забирает неэтерифицированный холестерин и компоненты апопротеина (Аро) С у хиломикронов и остатков ЛПОНП для повторного использования новыми частицами, богатыми триглицеридами. Этот «центростремительный» поток холестерина — один из механизмов его удаления из периферического кровообращения и распределения в частицы, богатые триглицеридами. Частицы ЛПВП содержат довольно много холестерина, но в них нет липопротеинов В и Е, необходимых для рецепторно-обусловленного поглощения частиц ЛПНП и ЛПСП. Холестерин в частицах ЛПВП и триглицерид-обогащенных частицах ЛПОНП является менее атерогенным, чем холестерин, содержащийся в частицах ЛПНП и ЛПСП.
Гиполипидемические средства действуют на разные этапы липопротеинового обмена
Гиперлипидемия распространена во многих странах и связана с сердечно-сосудистыми заболеваниями типа атеросклероза и его осложнениями. Ее обычные проявления — повышение ЛПНП, ЛПОНП или обоих липопротеинов вследствие комбинации наследственности и избыточного питания. Некоторые гиперлипидемические синдромы имеют генетическую основу, но таких меньшинство. Специфические механизмы гиперлипидемии:
- дефектные рецепторы ЛПНП (наследственная гиперхолестеринемия);
- избыточная выработка аполипопротеина В (наследственная комбинированная гиперлипидемия);
- дефицит липопротеинлипазы (гиперлипидемия I типа, первичная гипертриглицеридемия);
- недостаточная очистка остаточных частиц (гиперлипидемия III типа, наследственная дисбеталипо-протеинемия).
Для систематизации этих нарушений обычно применяют классификацию гиперлипидемии по Фридриксону (табл. 11.15).
Лекарственная терапия гиперлипидемий включает целый ряд средств, влияющих на синтез холестерина, снижение холестерина в желчи и метаболизм ЛПНП и ЛПОНП. Метаболизм холестерина и липопротеинов под действием таких средств показан на рис. 11.12.
Рис. 11.12 Место действия гиполипидемических средств. Ингибиторы гидроксиметилглутарил коэнзим А редуктазы (ГМГ-КоА-редуктазы) приводят к увеличению плотности рецепторов липопротеина низкой плотности (ЛПНП-R) на гепацитах и усилению клиренса ЛПНП в плазме. Секвестранты желчных кислот также увеличивают клиренс ЛПНП и потерю холестерина в желчи. Производные фиброевой кислоты усиливают действие липопротеинлипазы (LPL) в периферических тканях, что ведет к усилению клиренса частиц, богатых триглицеридами. Никотиновая кислота ограничивает приток свободных жирных кислот (FFA) из жировой ткани, уменьшая выработку липопротеинов очень низкой плотности (ЛПОНП). При сокращении выработки продукции ЛПОНП для синтеза ЛПНП доступно меньше ремнантов.
|
Таблица 11.15 Классификация гиперлипидемий по Фридриксону | ||
|
Тип |
Концентрация холестерина и триглицеридов в сыворотке крови |
Уровень специфических липопротеинов |
|
I |
X слегка увеличена ТГ сильно увеличена |
Хиломикронов увеличен, ЛПОНП в норме |
|
IIа |
X увеличена ТГ в норме |
ЛПНП увеличен |
|
IIb |
X увеличена ТГ увеличена |
ЛПНП и ЛПОНП увеличен |
|
III |
X увеличена ТГ увеличена |
Избыток остаточных частиц ЛПСП |
|
IV |
X в норме ТГ увеличена |
ЛПОНП увеличен |
|
V |
X слегка увеличена ТГ сильно увеличена |
Хиломикронов увеличен, ЛПОНП увеличен |
Ингибиторы ГМ Г-КоА-редуктазы
Исследования биосинтеза холестерина в 1950-х гг. привели к открытию средств, подавляющих разные этапы в процессе его метаболизма. Ингибирование стадии, определяющей скорость катализа и выработку фермента гидроксиметилглутарил коэнзим А редуктазы, полученного из грибов, приводит к снижению холестерина без увеличения токсичных производных стерина. ГМГ-КоА-редуктаза высвобождает предшествующую холестерину мевалоновую кислоту из кофермента А. Конкурентные ингибиторы ГМГ-КоА-редуктазы (так называемые ста-тины) обусловливают компенсаторные клеточные реакции — повышение экспрессии ГМГ-КоА-редуктазы и рецепторов ЛПНП.
Большинство статинов подвергаются пресистемному метаболизму в печени на 50-80%, в результате концентрация препарата в большом круге кровообращения низкая. Период полувыведения составляет от 2 час (правастатин, флувастатин) и до 14 час (аторвастатин). Симвастатин и ловастатин — пролекарства, требующие фармакологически активного окислительного расщепления лактонового кольца.
Большинство статинов (кроме правастатина и флувастатина) метаболизируется CYP3A4, поэтому могут вызывать побочные эффекты при взаимодействия с другими лекарственными препаратами. Циклоспорин, не являющийся субстратом CYP3A4, увеличивает концентрации правастатина, что, возможно, связано с транспортом Р-гликопротеина.
Ингибиторы ГМГ-КоА-редуктазы снижают уровень холестерина ЛПНП сильнее других гиполипидемических препаратов (табл. 11.16). Самый явный эффект статинов — снижение уровня холестерина ЛПНП, но наблюдается также и снижение частиц ЛПОНП в холестерине, в то время как уровень холестерина ЛПВП может немного увеличиться. Низкая активность статинов в понижении ЛПОНП и увеличении холестерина ЛПВП ограничивает их применение в качестве монотерапии при комбинированных гиперлипидемиях. Другие механизмы действия, например непосредственное влияние на остановку процессов атерогенеза в сосудистой ткани, не были подтверждены.
Побочные эффекты гиполипидемических средств
- Ингибиторы ГМГ-КоА-редуктазы: активация фермента печени креатинфосфокиназы (миозит)
- Секвестранты желчных кислот: метеоризм, запоры, неполное всасывание лекарственных средств
- Производные фиброевой кислоты: желчнокаменная болезнь, активация креатинфосфокиназы (миозит)
- Ниацин: вазомоторные гиперемии, зуд, гиперурикемия, непереносимость глюкозы, язва желудка и двенадцатиперстной кишки, холестатическая желтуха, гиперпигментация
- Препараты с замедленным высвобождением ниацина и комбинация ингибиторов ГМГ-КоА-редуктазы с производными фиброевой кислоты: повышение риска возникновения миозита
Секвестранты желчных кислот
Концентрацию холестерина в плазме крови можно снизить сочетанием снижения приема липидов с пищей и препаратов, связывающих желчные кислоты в просвете кишечника. Холестирамин, колестипол, колесевелам — это смолы, связывающие желчные кислоты и подавляющие их реабсорбцию. При их назначении увеличивается накопление печенью холестерина для обеспечения нужд организма в выработке желчи. Это приводит к более быстрому клиренсу циркулирующих частиц ЛПНП и ЛПСП. Максимальные дозы смол уменьшают уровень холестерина ЛПНП примерно на 20%, не оказывая существенного влияния на концентрацию холестерина ЛПВП. Концентрация ЛПОНП обычно повышается во время начального периода терапии, поскольку эти препараты могут обострять гипертриглицеридемию. Секвестирующие желчные кислоты смолы не всасываются и связывают другие жирорастворимые вещества, например витамины А и D, а также некоторые лекарственные средства, что ведет к симптомам недостаточного усвоения препаратов и питательных веществ. Секвестранты желчных кислот вызывают незначительно выраженные побочные эффекты со стороны желудочно-кишечного тракта (вздутие живота и запоры).
Производные фиброевой кислоты
В отличие от действия ингибиторов ГМГ-КоА-редуктазы, в основном понижающих ЛПНП, производные фиброевой кислоты (фибраты), такие как гемфиброзил, фенофибрат, безафибрат и клофибрат, увеличивают клиренс частиц ЛПОНП. Первый препарат этой группы лекарств (клофибрат) был открыт в начале 1960-х гг. Позднее было выявлено, что фибраты — агонисты рецепторов активации пролиферации пероксисом а-подкласса (PPAR-a), которые являются факторами клеточной транскрипции. Фибраты увеличивают активность периферийной липопротеинлипазы путем снижения транскрипции апопротеина CIII, ингибирующего кофактор для липопротеинлипазы.
Усиление функции липопротеинлипазы облегчает поступление триглицеридов из ЛПОНП и хиломикронов в ткани-мишени. Фибраты также увеличивают транскрипцию аполипопротеинов AI и All, которые облегчают переход холестериновых эфиров из ЛПОНП в ЛПВП, снижая таким образом содержание холестериновых остаточных частиц и увеличивая содержание частиц ЛПВП. При максимальных дозах гемфиброзила уровень холестерина ЛПВП увеличивается приблизительно на 20%, в то время как активные концентрации триглицеридов сокращаются примерно на 50%.
Холестерин ЛПНП сокращается приблизительно на 10% (механизм эффекта не ясен).
Период полувыведения гемфиброзила равен = 1,5 час, препарат вводят 2 раза в день. У другого часто применяемого фибрата, фенофибрата, период полувыведения составляет = 20 час, и препарат принимают 1 раз в день. Несмотря на различия в фармакокинетике, все фибраты имеют сходную эффективность. Производные фиброевой кислоты используют при патологии, связанной с увеличением циркуляции триглицеридов (гиперлипидемии IIb и IV типов). Эти препараты особенно эффективны при наследственной дисбеталипопротеинемии (гиперлипидемии III типа), возникающей из-за нарушения клиренса остатков Аро Е. Генетический недостаток липопротеинлипазы (гиперлипидемия I типа) характеризуется заметным подъемом триглицеридов, но не связан с фибратами. Гемфиброзил снижает риск первого инфаркта миокарда в среднем возрасте у людей с концентрацией холестерина не-ЛПВП более 200 мг/дл (Helsinki Heart Study), а также риск повторного инфаркта миокарда у людей с концентрациями холестерина ЛПВП менее 40 мг/дл (VA-HIT Study). Фибраты хорошо подходят для лечения дислипидемии у больных диабетом, поскольку обусловливают гипертриглице-ридемию и низкие уровни ЛПВП.
Ниацин
Ниацин(никотиновая кислота) — предшественник никотинамидадениндинуклеотида (НАД) и его фосфата — НАДФ. Действие ниацина на метаболизм липопротеина не зависит от его роли предшественника никотинамида, хотя ниацин используют для лечения гиперлипидемии на протяжении многих лет. Механизм действия изучен плохо, но известно, что препарат уменьшает выработку ЛПОНП путем снижения транспорта жирных кислот от жировой ткани в печень. Снижение концентрации ЛПОНП ведет к уменьшению обмена холестерина и ЛПВП (таким образом, к более высоким концентрациям холестерина), а также к уменьшению поставки ЛПСП в печень для образования ЛПНП. Вследствие таких компенсаторных изменений в обмене жиров и белков ниацин оптимизирует терапевтический эффект повышения ЛПВП, понижая уровень холестерина ЛПНП и триглицеридов, поэтому ниацин рекомендуется при лечении комбинированных гиперлипидемий.
Побочное действие ниацина зависит от дозы и проявляется покраснением и зудом кожи. Этот эффект обусловлен простагландином. Сопутствующий прием аспирина предупреждает развитие этих нежелательных явлений. Организм пациентов, длительное время принимающих ниацин, толерантен к этим эффектам, но не к терапевтическому действию на липопротеины. Другими побочными эффектами могут быть обострение язвы желудка и двенадцатиперстной кишки, гипер-урикемия, непереносимость глюкозы, поражение печени и скелетных мышц. Это может ограничить применение ниацина. В то же время препараты ниацина с замедленным высвобождением пациенты переносят хорошо. Ниацин с замедленным высвобождением лучше снижает уровень ЛПНП, но максимальная эффективность разных форм ниацина сходна.
Другие гиполипидемические средства
Пробукол — гиполипидемическое средство с минимальным холестериноснижающим действием, но этот препарат уменьшает окисление ЛПНП. Окисленный ЛПНП более активно включается макрофагами в продуцирование пенистых клеток и атеросклеротических кровяных телец (тромбоцитов). Тем не менее пробукол применяют нечасто, т.к. он больше снижает уровень ЛПВП, а не ЛПНП, и на фоне его применения возможно развитие желудочковой аритмии.
Рыбий жир содержит омега3-жирные кислоты, например эйкозапентаеновую кислоту, являющуюся важнейшей липидной составляющей клеточных мембран. Потребление в пищу рыбных жиров приводит к снижению синтеза ЛПОНП. Омега3-жирные кислоты сокращают выработку метаболитов арахидоновой кислоты и, следовательно, агрегацию тромбоцитов. Обычная доза для сокращения гипертриглицеридемии — 5 г 2 раза в день. Рвота и отрыжка — самые распространенные побочные эффекты. Считается, что причиной низкого распространения сердечно-сосудистых заболеваний у народов, живущих у моря, является гиполипидемическое действие омега3-жирных кислот.
Сокращение потребления холестерина как часть лечения гиперлипидемий
Перед началом лекарственной терапии гиперлипидемии рекомендуется сокращение потребления холестерина с пищей и лечение усугубляющих уровень холестерина состояний, например сахарного диабета, болезней почек, холестатических расстройств, гипотиреоза и недоразвития половой системы. Снижение массы тела способствует как общему улучшению состояния пациента в связи с нормализацией липидного обмена, так и снижению артериального давления и повышению чувствительности к инсулину. Если изменений в образе жизни недостаточно, а факторы риска скорректированы, можно начинать лечение, направленное на снижение липидов в соответствии с учетом наиболее повышенного их компонента, например:
- производные никотиновой или фиброевой кислоты для триглицеридов;
- секвестранты желчных кислот или ингибиторы ГМГ-КоА-редуктазы для ЛПНП-холестерина.
Комбинированная терапия секвестрантами желчных кислот и другими препаратами безопасна и обычно дает дополнительный холестериноснижающий эффект. Комбинации никотиновой кислоты, ингибиторов ГМГ-КоА-редуктазы и производных фиброевой кислоты эффективны, но могут быть токсичными для печени или скелетных мышц.
Нарушения синтеза глюкокортикостероидов и других гормонов, вырабатываемых при стрессах
Гипоталамо-гипофизарно-надпочечниковая система вырабатывает гормоны надпочечника: глюкокортикостероиды и эпинефрин. Они оказывают эффект, определяемый термином «общий адаптационный синдром». Б 1940-х гг. Ганс Селье впервые употребил этот термин для описания адреналинового ответа на ситуацию «бороться или бежать». Эта концепция гормонально-регулируемой адаптации к условиям острого физиологического стресса, например при травме, кровопотере, соматической инфекции или воздействии окружающей среды, обеспечивает основу для понимания различного действия глюкокортикостероидов и катехоламинов (рис. 11.13).
Рис. 11.13 Глюкокортикостероиды и адаптация к стрессу, (а) Множество нейросенсорных путей регулируют секрецию кортикотропин-рилизинг гормона (CRH) в гипоталамусе. CRH стимулирует выброс адренокортикотропного гормона (АСТН). АСТН усиливает синтез кортизола в надпочечниках. Кортизол поступает в ткани, где связывает цитозольные глюкокортикостероидные рецепторы (GR) (б). Эти рецепторные комплексы перемещаются к ядру, где запускают транскрипцию элементов ответа на глюкокортикостероиды (CRE). Продукты этих генов оказывают разнообразные эффекты на ткани-мишени: увеличение гликонеогенеза, липолиз, катаболизм ткани, подавление лимфоцитарной функции, вазопрессорный эффект и влияние на поведение, (в) Дневная схема синтеза кортизола отражает пиковую деятельность гипоталамо-гипофизарно-надпочечниковой системы рано утром. мРНК — матричная рибонуклеиновая кислота; ЦНС — центральная нервная система.
При стрессе гормон гипоталамуса, кортикотропин-рилизинг гормон (CRH), приводит к выбросу гипофизарного адренокортикотропного гормона,что обеспечивает повышенную выработку кортизола в зоне веретенных клеток надпочечников. Симпатическая нервная система высвобождает нейронный норэпинефрин и секреты эпинефрина из надпочечниковых медулл.
Кортизол усиливает синтез эпинефрина и повышает чувствительность периферических тканей к действию катехоламинов. Общий эффект глюкокортикостероидов и катехоламинов заключается в подготовке организма к высокой физической или стрессовой активности: повышается гликонеогенез и липолиз, мобилизуется доставка энергии в мышцы, активируется ЦНС, повышается артериальное давление, подавляется воспаление и задерживается заживление ран.
Симпатическая нервная система усиливает эти эффекты, увеличивая давление крови, учащая пульс, повышая содержание глюкозы в крови, липолиз, активируя ЦНС, вызывая прилив крови в мышцы, усиливая коагуляцию и тромбоцитарную активность.
Длительный избыток «стрессовых» гормонов может привести к различным физиологическим нарушениям
Краткосрочная активация «стрессовых» гормонов может быть полезной, но избыток этих гормонов в течение продолжительного времени может привести к гормональным расстройствам в форме общего адаптационного синдрома, включающего:
- хроническое подавление функции лимфоцитов глюкокортикостероидами, предрасполагающее к инфекциям, в том числе паразитарным и грибковым;
- хронический избыток контринсулярных гормонов, что может привести к сахарному диабету;
- гипертензию.
У глюкокортикостероидов имеются и малоизученные побочные эффекты:
- стимуляция резорбции костей;
- подавление кишечной абсорбции Са2+;
- подавление выработки гонадотропина;
- накопление и перераспределение жировых тканей;
- влияние на эффекты вазопрессина в почках.
Половые стероиды — важные анаболические гормоны для костей, их комбинированный с глюкокортикостероидами эффект на гонадотропины, баланс Са2+ и физиологию костей является фактором риска остеопороза как для мужчин, так и для женщин.
Дефицит глюкокортикостероидов
Дефицит глюкокортикостероидов даже в отсутствие стресса приводит к глубоким патофизиологическим нарушениям. Глюкокортикостероидная недостаточность возникает вследствие:
- гипоталамо-гипофизарных заболеваний, ведущих к пониженной секреции АСТН;
- разрушения коры надпочечников аутоиммунными процессами (болезнь Аддисона), разрушающими новообразованиями, инфарктом или инфекциями;
- подавления функций системы ГГН из-за избыточного или длительного лечения экзогенными глюкокортикостероидами воспалительных, аутоиммунных или аллергических заболеваний (ятрогенная надпочечниковая недостаточность).
Все эти синдромы сопровождаются клиническими признаками дефицита глюкокортикостероидов: плохой аппетит, потеря массы тела, усталость, головная боль, артралгия и сниженный сердечнососудистый резерв.
Однако у пациентов с недостаточностью отсутствуют:
- дефицит надпочечникового солесберегающего гормона альдостерона, т.к. он поддерживается ренин-ангиотензиновой системой;
- компенсаторные повышения АСТН и относящийся к ним гипофизарный меланоцитостимулирующий гормон, который приводит к повышению пигментации кожи.
Более того, у пациентов с первичным дефицитом надпочечниковых гормонов (болезнь Аддисона) из-за недостатка альдостерона наблюдается пониженное артериальное давление и гиперкалиемия.
Синтетические глюкокортикостероиды различают по силе, продолжительности действия и сопутствующему минералокортикостероидному эффекту
Глюкокортикостероиды назначают для коррекции следующих состояний:
- нехватки гормонов надпочечников;
- подавления сверхактивности системы ГГН;
- подавления аутоиммунных заболеваний;
- предотвращения отторжения при пересадках органов;
- лечения лимфоцитарных опухолей;
- лечения аллергических расстройств, например астмы и кожных нарушений.
Глюкортикостероиды применяют при широком спектре заболеваний. Цель лечения дефицита гормонов надпочечников состоит в имитации физиологического действия кортизола. При лечении других болезней глюкокортикостероиды применяют в дозах выше физиологических, цель назначения состоит в достижении максимальной терапевтической пользы и минимизации побочных эффектов, таких как ятрогенная надпочечниковая недостаточность, остеопороз, атеросклероз, инфекции и психоневрологические расстройства.
Для уменьшения побочных эффектов глюкокортикостероидной терапии используют различные стратегии
Одной из стратегий, нацеленных на уменьшение побочных эффектов терапии глюкокортикостероидами, является перемежающееся дозирование, например прием лекарства через день при аллергических заболеваниях. В данном случае используют различия в периодах полувыведения различных глюкокортикостероидов. Доказано, что глюкокортикостероиды подавляют аллергические проявления при приеме каждые 48 час, а подавление системы ГГН более краткосрочное. Одна и та же доза глюкокортикостероида при введении каждые 2 дня может дать желательный терапевтический эффект при меньшем риске ятрогенной недостаточности надпочечников, чем более частый прием.
Побочные эффекты глюкокортикостерондов
- Подавление системы ГГН (постоянное или временное)
- Остеопороз
- Нарушения обмена глюкозы
- Повышенный риск атеросклероза
- Миопатия
- Подавление иммунитета
- Катаракта
- Аваскулярный некроз костей (например, головки бедра)
- Психоневрологические расстройства
Другой способ оптимизации терапии — местное применение глюкокортикостероидов при псориазе и контактном дерматите и ингаляции при астме и хронических обструктивных болезнях легких.
При ингаляциях достигаются более высокие местные концентрации глюкокортикостерондов при незначительном увеличении их уровня в крови, таким образом уменьшаются побочные эффекты. Тем не менее топические глюкокортикостероиды при лечении хронических заболеваний усваиваются в количествах, достаточных для подавления функции гипофиза. Терапевтический эффект также улучшается при приеме плохо усваиваемых или быстро разлагающихся в печени глюкокортикостероидов.
Глюкокортикостероиды различаются по эффективности, продолжительности действия и степени минералокортикостероидной активности
Терапевтическая эффективность любого глюкокортикостероида определяется четырьмя факторами:
- концентрацией препарата в тканях-мишенях;
- степенью активности;
- продолжительностью действия;
- периодом полувыведения.
Сравнение эффективности глюкокортикостероидов позволяет выбрать препарат для адекватной замены (табл. 11.17). Однако оценки эффективности неточны, т.к. не дают полной картины длительности действия. Например, дексаметазон имеет в 7 раз более высокий аффинитет к рецепторам, чем гидрокортизон, но в 150 раз сильнее подавляет функцию надпочечников уже через 1 день после однократного приема. Синтетические глюкокортикостероиды длительного действия, такие как дексаметазон и бетаметазон, с большей вероятностью будут подавлять функции гипофиза, чем средства короткой продолжительности действия.
Если терапию гидрокортизоном проводят при надпочечниковой недостаточности для создания естественного профиля секреции кортизола, то утром и после обеда назначают неравные дозы препарата, чтобы более точно воспроизвести физиологическую реакцию (рис. 11.14). Эндогенно вводят кортизол в дозе = 10 мг/сут (28 ммоль/сут). Гидрокортизон высокоактивен, но при замене часто бывают необходимы большие ежедневные дозы.
Рис. 11.14 Заместительная терапия глюкокортикостероидами. В норме у взрослого человека вырабатывается = 10 мг/сут кортизола. Синтез кортизола претерпевает выраженные изменения в течение дня, с повышением в утренние часы перед пробуждением. Физиологическая замена оральным гидрокортизоном имитирует этот эндогенный ритм.
Синтетические глюкокортикостероиды обладают различной минералокортикостероидной активностью, синтетические минералокортикостероиды (например, флудрокортизон) также назначают при лечении недостаточности функции надпочечников.
В основе всех глюкокортикостероидов, природных и синтетических, лежит стероидное кольцо — 17-углеродная химическая структура из четырех соединенных колец. Стероидное кольцо, используемое в эндогенном синтезе глюкокортикостероидов, образуется из холестерина. Эндогенные глюкокортикостероиды в основном имеют гидроксильные радикалы, прикрепленные к стероидному кольцу в типичных местах. Радикалы многих синтетических глюкокортикостероидов представлены преимущественно фтором. Эти радикалы не изменяют существенно действия глюкокортикостероидов, однако определяют степень минералокортикостероидной активности. Помимо изменения соотношения глюкокортикостероидной и минералокортикостероидной активности, радикалы изменяют фармакокинетику. Например, флутиказон очень плохо усваивается, поэтому его применяют местно, но он очень быстро метаболизируется в печени.
|
Таблица 11.17 Характеристика синтетических глюкокортикостерондов | |||||
|
Лекарственные средства |
Эффективная доза (мг) |
Глюкокортикостероидная активность относительно гидрокортизона |
Минералокортикостероидная активность относительно гидрокортизона |
Т1/2 (час) |
Длительность действия (час) |
|
Гидрокортизон (кортизол) |
20 |
1 |
1 |
1,5-2 |
8-12 |
|
Преднизон |
5 |
4 |
0,8 |
3,5 |
18-36 |
|
Преднизолон |
5 |
4 |
0,8 |
3,5 |
18-36 |
|
Метилпреднизолон |
4 |
5 |
0,5 |
2-3 |
18-36 |
|
Триамцинолон |
4 |
5 |
0 |
3,0 |
18-36 |
|
Дексаметазон |
0,75 |
20-50 |
0 |
3,5 |
18-36 |
|
Бетаметазон |
0,6 |
20-50 |
0 |
4,0 |
18-36 |
Синдром Кушинга —результат избытка глюкокортикостероидов
Роль глюкокортикостероидов проявляется наиболее наглядно при сильном стрессе, но кортизол вырабатывается в биологически активном количестве также и в нестрессовых условиях. Выброс и синтез кортизола соответствует дневному ритму, увеличиваясь в предрассветные часы из-за активации системы ГГН (см. рис. 11.13, 11.14). Таким образом, выработка кортизола максимальна рано утром, а к ночному периоду она может уменьшиться до очень низкого уровня.
Избыточный уровень глюкокортикостерондов приводит к развитию синдрома Кушинга, характеризующегося мышечной слабостью, перераспределением отложения жира в подкожной клетчатке, луновидным лицом, пурпурными стриями на коже брюшной стенки, атрофией кожи, ломкостью капилляров, гипертензией, непереносимостью глюкозы и психоневрологическими нарушениями. Синдром Кушинга развивается на фоне множества причин, но обычно он возникает из-за АСТН-синтезирующей аденомы гипофиза (синдром Кушинга) (рис. 11.15), кортизол-вырабатывающей опухоли надпочечников или атопического синтеза АСТН в других новообразованиях (например, нейроэндокринными опухолями легких и кишечника). Признаки и проявления синдрома Кушинга перечислены в табл. 11.18.
Основное лечение синдрома Кушинга — хирургическое удаление гормонсинтезирующей опухоли. Если хирургическое вмешательство не эффективно, для коррекции избытка глюкокортикостерондов применяют лекарственную терапию. Самые эффективные препараты — ингибиторы надпочечникового синтеза глюкокортикостерондов (кетоконазол, метирапон, аминоглутетимид и митотан). Лекарств, уменьшающих выработку АСТН аденомой гипофиза, не существует, а эффективность антагониста глюкокортикостероидных рецепторов мифепристо-на при хроническом синдроме Кушинга не подтверждена. Ингибиторы биосинтеза стероидов действуют на различные этапы синтеза кортизола, поэтому для них характерно сопутствующее влияние на другие стероиды надпочечников (рис. 11.16).
Таблица 11.18 Проявления синдрома Кушинга
- Миопатия
- Атрофия скелетных мышц
- Луновидное лицо
- Надключичные и дорсолатеральные «подушки» жира (ложный горб)
- Пигментированные стрии на животе
- Гирсутизм
- Полнокровие
- Хрупкость кожи и капилляров
- Гипертензия
- Непереносимость глюкозы
- Гипокалиемия
- Атеросклероз
- Инфекции
- Психоневрологические расстройства
- Недоразвитие половой системы
МЕТИРАПОН. Этот препарат в основном подавляет терминальный этап синтеза кортизола (11-гидроксилирование), приводя к увеличению содержания его предшественника 11-деоксикортизола. Накопление таких предшественников, как 17-гидроксипрогестерон, может привести к увеличению синтеза андрогенов надпочечниками (как и стероидов) и гирсутизму у женщин. Метирапон влияет на синтез альдостерона, однако предшественник кортизола 11-деоксикортизол обладает минералокортикостероидной активностью, что может привести к задержке электролитов и гипертензии.
КЕТОКОНАЗОЛ И АМИНОГЛУТЕТИМИД. Кетоконазол, антимикотическое производное имидазола (см. главу 6), и аминоглутетимид, противоэпилептический препарат (см. главу 8), подавляют различные этапы стероидогенеза, включая точку входа разветвления боковой цепи холестерина, а также другие важные этапы биосинтеза кортизола и андрогена (см. рис. 11.16). Механизм действия кетоконазола при лечении избытка глюкокортикостероидов состоит в подавлении активности ферментов цитохрома Р-450, вовлеченного в биосинтез стероидов, ингибирующих биосинтеза эргостероида в мембранах грибов, что обусловливает антимикотический эффект препарата.
Рис. 11.16 Ингибиторы синтеза глюкокортикостерондов. Ингибиторы надпочечникового синтеза глюкокортикостероидов действуют на различных этапах синтеза. Кетаконазол, аминоглутетимид и митотан действуют в начале ответвления боковой цепочки холестерина (P-450scc), который поставляет стероидогенный экстракт в схему синтеза. Кетоконазол и аминоглутетимид являются конкурентными ингибиторами фермента цитохрома Р-450 и действуют также в других местах схемы синтеза. Эти агенты уменьшают секрецию надпочечниковых андрогенов (DHEA и андростенедиона) подавлением 17а-гидроксилазы (Р-450с17), что может привести к недостатку андрогенов у мужчин. Метирапон ингибирует фермент конечного этапа синтеза кортизола, llp-гидроксилазу (Р-450с11), приводя к наращиванию предшественников с андрогенной потенцией минералокортикостероида. 3pHSD/ISOM — зргидроксистериод изомераза; DHEA — дегидроэпиандростерон; Р-450с21 —21а-гидроксилаза.
ПОБОЧНЫЕ ЭФФЕКТЫ КЕТОКОНАЗОЛА, АМИНОГЛУТЕТИМИД А И МЕТИ РАЙОНА. Все ферменты, участвующие в биосинтезе стероидов, подавляемом кетоконазолом, аминоглутетимидом и метирапоном, принадлежат к большому семейству ферментов цитохрома Р-450, которые катализируют реакцию монооксигенации. Ферменты цитохрома Р-450 вовлечены во многие биосинтетические реакции лекарственного метаболизма, что обусловливает некоторые побочные эффекты препаратов. Поскольку выработка стероидов ограничена и многие участки выработки энзимов ингибированы, биологически активные молекулы предшественников стероидов не накапливаются. Однако эти препараты подавляют также синтез половых стероидов, что может привести к атрофии половой системы у мужчин.
МИТОТАН. Подавляет синтез стероидов в АСТН-регулируемом этапе разветвления боковой цепи холестерина, а также вызывает атрофию коры надпочечников. Митотан применяют только при лечении рака надпочечников из-за желудочно-кишечной токсичности препарата.
Феохромоцитома и избыток катехоламинов
При артериальной гипертензии иногда трудно определить ее истинную причину. У небольшой части пациентов гипертензия обусловлена избыточным синтезом минералокортикостероидов, глюкокортикостероидов или катехоламинов феохромоци-томой. В последнем случае норэпинефрин или эпинефрин вырабатывается опухолевыми клетками мозгового вещества надпочечников или эктопическими тканями. Высокие концентрации катехоламинов в плазме крови повышают артериальное давление через (Xj-адренорецепторы сосудов и a1-адренорецепторы сердца. Действий, направленных на снижение артериального давления (вазодилатация через β2-адренорецепторы или торможение симпатических нейронов активацией пресинаптических а2-адренорецепторов), иногда недостаточно для нормализации гемодинамики при феохромоцитоме. Общие симптомы феохромоцитомы: головная боль, сердцебиение, избыточное потоотделение, потеря массы тела. Неизбирательный адренергический антагонист а-рецепторов феноксибензамин является основной лекарственной терапии до хирургического вмешательства.
Феноксибензамин — конкурентный антагонист как а1, так и а2-адренорецепторов с длительным периодом полувыведения в плазме (около 24 час) и необратимым характером связывания с рецепторами. Прием препарата начинают с дозы 10 мг перорально 2 раза в день и титрируют, увеличивая дозу с учетом артериального давления, каждые 3-5 дней.
Фентоламин, конкурентный обратимый антагонист а1 и а2-адренорецепторов с коротким периодом полувыведения (20 мин), используют для управляемой гипотонии во время операции, но при амбулаторном лечении феохромоцитомы применяют очень редко. Побочные эффекты препарата: постуральная гипотония, отек слизистой оболочки полости носа, сексуальная дисфункция. Избирательные антагонисты а1-адренорецепторов, такие как теразозин и доксазозин, не изучали в плане их применения при феохромоцитоме.
В случаях рефрактерной к терапии феохромоцитомы можно использовать ингибитор биосинтеза катехоламинов а-метилтирозин. Метилтирозин — конкурентный ингибитор тирозингидроксилазы, тормозящий синтез катехоламина. У метилтирозина относительно короткий период полувыведения в плазме (4-7 час), препарат назначают в стартовой дозе 250 мг и доводят до дозы 1,0 г перорально 4 раза в день. Побочные эффекты — сонливость, слабость и экстрапирамидные двигательные расстройства (ригидность и тремор) — встречаются довольно часто.
Минералокортикостероиды, вазопрессин и изменения объема циркулирующей крови
Гипоталамус, гипофиз и надпочечники участвуют в гормональной регуляции внеклеточного объема жидкости (рис. 11.17). Гипофиз и надпочечники регулируют объем крови посредством двух взаимозависимых механизмов, контролирующих баланс Na+ (минералокортикостероиды надпочечников) и воды (гипофизарный вазопрессин).
Рис. 11.17 Гормональное регулирование объема плазмы крови. Рефлексы сердечно-сосудистой системы, почечные барорецепторы и отдаленные тубулярные сенсоры Na+ обеспечивают физиологический входной сигнал о циркуляционном объеме (а, б). В ответ на уменьшенную почечную перфузию клетки, расположенные рядом с клубочком и принадлежащие центростремительной клубочковой артерии, выделяют ренин. Ренин преобразовывает циркулирующий ангиотензиноген в ангиотензин I, который затем преобразуется в ангиотензин II ангиотензинпревращающим ферментом (АПФ) в сосудистом эндотелии (а). Ангиотензин II и ангиотензин III стимулируют продукцию альдостерона, что ведет к реабсорбции Na+ в дистальных извитых канальцах. Реабсорбция Na+ увеличивает осмотическое давление внеклеточной жидкости, что стимулирует гипоталамические осморецепторы к выработке вазопрессина задним отделом гипофиза. Вазопрессин приводит к увеличенной реабсорбции свободной жидкости в собирательных канальцах, что увеличивает внеклеточный объем и уменьшает осмотическое давление в плазме (в).
Ион Na+ и сопровождающие его анионы (С1 и НС03) — главные элементы осмотической системы. Потеря Na+ через почки, кишечник и потовые железы определяет объем внеклеточной жидкости. Внеклеточная жидкость разделяется на сосудистую и внутритканевую, поэтому внеклеточный объем — главная определяющая гомеостаза объема и давления крови. Осмотический состав внеклеточной воды заставляет свободную воду перемещаться из внутриклеточных депо во внеклеточные отделы.
Задержка натрия в периферических почечных канальцах регулируется альдостероном, влияющим на гены, отвечающие за синтез Nа+/К+-АТФазы и обмен Na+ и Н+
Уровень Na+ регулируется в почках минералокортикостероидным гормоном альдостероном, ангиотензином (AT) II, симпатической нервной системой, предсердным натрийуретическим пептидом и внутренними почечными механизмами.
Почечный механизм регуляции объема крови и ренин-ангиотензин-альдостероновая система (РААС) рассмотрены в других главах. Афферентные отделы этой системы — почечные барорецепторы мелких артерий, почечные тубулярные Nа+-рецепторы и объемные рецепторы в центральных венах — стимулируют выработку ренина в ответ на уменьшение объема крови или снижение почечной перфузии. Влияние ренина на содержание в крови предшественников ангиотензиногена приводит к синтезу пептидного ангиотензина I, который преобразуется в ангиотензин II и ангиотензин III в периферических тканях, преимущественно в легких. Ангиотензин II и III действуют на гломерулозу надпочечников, повышая синтез альдостерона (рис. 11.18). Синтез альдостерона сходен с синтезом кортизола, за исключением двухступенчатого образования 18-альдегидной группы энзимами ангиотензин 11-чувствительной метилоксидазы I и II, представленной только в гломерулярной области надпочечников (см. рис. 11.18).
Рис. 11.18 Минералокортикостероиды и регулирование баланса Na+. Ангиотензины II и III регулируются ферментом кортико-стеронметилоксидазой (СМО) I и II, катализирующим гидроксили-рование и образование альдегида в 18-С кортикостерон. Циркулирующий альдостерон связывается с цитозольными рецепторами минералокортикостероидов (MR), которые перемещаются к ядру для регулировки экспрессии генов, реагирующих на минералокортикостероиды (MRE). Почечные трубчатые эпителиальные клетки экспрессируют №+/К+-АТФазу, люминальную Ма+-пермеазу, подкачку протона в просвет канальца и митохондриальные ферменты, необходимые для выработки аденозинтрифосфата (АТФ). Чистый эффект альдостероновой стимуляции в дистальном извитом канальце — реабсорбция Na+ и выведение К+ и Н+. Спиронолактон — конкурентный антагонист MR, а мочегонные средства амилорид и триамтерен противодействуют 1Ма+/К+-АТФазе. АДФ — аденозинди-фосфат; мРНК — матричная рибонуклеиновая кислота.
Альдостерон, как и другие стероидные гормоны, активирует гены в тканях, служащих рецепторами минералокортикостероидов (почки, мозг, сосуды). Эти рецепторы могут связать как альдостерон, так и кортизол; они защищены от глюкокортикостероидной стимуляции уникальным энзимом, 11β-гидроксистероидной дегидрогеназой. Этот фермент присутствует в тканях-мишенях минералокортикостероидов и избирательно инактивирует любые глюкокортикостероиды около минералокортикостероидных рецепторов.
Классическая мишень для минералокортикостероидов — эпителиальные клетки дистальных почечных спиралевидных канальцев, где минералокортикостероидная стимуляция активирует гены для Nа+/К+-АТФазы, ионные каналы и митохондриальные ферменты, необходимые для восстановления Na+ и выведения К+ и Н+. Вне почек минералокортикостероиды сохраняют ионы Na+ в желудочно-кишечном тракте и потовых железах и повышают кровяное давление, действуя на сосудодвигательный центр мозга и периферические сосуды. Минералокортикостероидные рецепторы также регулируют синтез коллагена фибробластами, и могут играть важную роль в коррекции сосудистых тканей, поврежденных ишемией или гемодинамическим стрессом. Выработка альдостерона стимулируется высоким содержанием сывороточного К+. Эта стимуляция — главный механизм защиты организма от опасной для жизни гиперкалиемии. Избыточное действие минералокортикостероидов приводит к экскреции К+ и Н+ почками (т.е. гипокалиемии и алкалозу) и увеличению объема выводимой жидкости, а нехватка минералокортикостероидов — к гиперкалиемии и уменьшению объема выводимой жидкости.
Водный баланс и баланс Na+ сопряжены через осморецепторы гипоталамуса, регулирующие гипофизарный синтез вазопрессина
РААС и симпатическая нервная система регулируют содержание Na+ и объем внеклеточной воды, но такой контроль возможен при условии, что свободный водный баланс поддерживает осмотическое равновесие. Выраженная задержка Na+ альдостероном приводит к увеличению содержания Na+ и повышенному осмотическому давлению внеклеточной жидкости. В результате вода перемещается из внутриклеточного пространства во внеклеточное, а гиперосмотическое давление начинает влиять на осморецепторные клетки гипоталамуса. Осмотическии сенсорный механизм вызывает синтез вазопрессина (антидиуретический гормон) задней долей гипофиза (рис. 11.19; см. рис. 11.17в).
Рис. 11.19 Вазопрессин и регулирование водного баланса. Осмотическая стимуляция приводит к выбросу вазопрессина из заднего отдела гипофиза (а). Вазопрессин стимулирует \/2-рецепторы удаленных трубчатых эпителиальных клеток. \/2-рецепторы — это G-белок-связанные рецепторы, стимулирующие адеиилилциклазу (АЦ) для увеличения внутриклеточного циклического аденозинмонофосфата (цАМФ) и активизирующие протеинкиназу А (ПКА). Это ведет к повышенной проходимости трубчатого эпителия (б). Увеличение проходимости собирающего канала приводит к свободному движению воды в гипертонический почечный медуллярный интерстиций. Контроль ПКА над водными порами показан на рис. 12.11. Вазопрессин также действует на сосуды через У,-рецепторы, связанные с фосфолипа-зой С (ФЛС р). Выброс инозитол-1,4,5-трифосфата (1Р3) и диацилглицерола (ДАГ) фосфатидилинозитолдифосфатом (Р1Р2) увеличивает внутриклеточный Са2+ и потенцирует вазопрессорные ответы (в). По мере роста осмотического давления с увеличением уровня вазопрессина в плазме активизируется механизм чувства жажды (г). АТФ — аденозинтрифосфат.
Вазопрессин — пептидный гормон с 9-амино-кислотными остатками. Циркулирующий вазопрессин стимулирует V2GPCR-peцeптopов, увеличивающие проходимость почечных канальцев через цАМФ. Это позволяет воде в канальцах перетекать во внеклеточное пространство почечного интерстициума. В результате свободная вода возвращается в депо, что вызывает в головном мозге сигнал по принципу отрицательной обратной связи. Тот же механизм вызывает, и подавляет чувство жажды. Помимо регулирования объема свободной воды вазопрессин стимулирует V1-рецепторы на мышцах сосудов, вызывая их сужение с помощью Са2+-зависимых внутриклеточных механизмов.
Выработка вазопрессина подавляется при снижении осмотического давления, что приводит к повышенным потерям воды в ответ на избыточное потребление жидкости. При значительном падении артериального давления (например, при шоке) вазопрессин высвобождается независимо от осмотического давления.
Дефицит минералокортикостероидов
Дефицит минералокортикостероидов обычно возникает при разрушении коры надпочечников (болезнь Аддисона), ассоциируемом как с ожидаемыми признаками дефицита минералокортикостероидов (гиперкалиемия, ацидоз, гиповолемия), так и с признаками дефицита глюкокортикостерондов (анорексия, слабость, потеря массы тела). Признаки дефицита минералокортикостероидов — уменьшение внеклеточного объема жидкости и следующая за этим постуральная гипотония, снижение тургора кожи и уменьшение выработки мочи. Внутриклеточная жидкость следует пассивно по осмотическому градиенту, сывороточная концентрация Na+ может быть в норме несмотря на общее уменьшение Na+. Дефицит минералокортикостероидов может возникать из-за вторичного дефицита ренина и/или высвобождения ангиотензина при хронической почечной недостаточности (гипоренинемиче-ская альдостеронопения).
Для лечения дефицита минералокортикостероидов независимо от причины возникновения применяют натрийсодержащие добавки и заместительную минералокортикостероидную терапию. Синтетические минералокортикостероиды включают 9а-флудрокортизон, мощный минералокортикостероидный агонист с минимальной глюкокортикостероидной активностью (см. рис. 11.186).
Дефицит вазопрессина (несахарный диабет)
Недостаточное действие вазопрессина возникает вследствие снижения его синтеза или ослабления его действия на почки:
- сниженная секреция вазопрессина обычно возникает из-за повреждений, разрушающих задний гипофиз (опухоли, гранулематозное воспаление, травма);
- ослабленная реакция на вазопрессин со стороны почек вызвана почечными заболеваниями и некоторыми лекарствами (табл. 11.19).
Диагностическим маркером дефицита вазопрессина является неспособность почек концентрировать мочу при увеличении внеклеточного осмотического давления (гипернатриемия). В отличие от нормальной сывороточной концентрации Na+, при дефиците минералокортикостероидов сывороточная концентрация Na+ увеличивается при нехватке воды.
Таблица 11.19 Причины несахарного диабета
- Нейрогенные (дефицит вазопрессина)
- Опухоли гипоталамуса и гипофиза
- Лимфоцитарный гипофизит
- Саркоидоз
- Инфекции (туберкулез, сифилис)
- Гистиоцитоз X
- Нефрогенные (резистентность к вазопрессину со стороны почек)
- Хронические заболевания почек
- Гипокалиемия
- Лекарства (соли лития, демеклоциклин, анестетики)
Для терапии несахарного диабета необходимо разграничение гипофизарных и почечных причин
Несахарный диабет лечат выведением вызвавших его лекарственных средств из организма или терапией заболевания почек.
При заболевании гипофиза, ведущего к дефициту вазопрессина, не всегда помогает терапия вызвавшего его воспаления или новообразования.
Вазопрессин-заместительная терапия включает применение синтетических аналогов вазопрессина (десмопрессин или липрессин). Эти препараты отличаются от природного вазопрессина замещением на лизин по восьмому положению (липрессин) или дезаминированием остатка цистеина в первом положении (десмопрессин). Препараты можно вводить с помощью интраназального спрея (предпочтительный способ введения в настоящее время) либо подкожной или внутримышечной инъекцией. Обычно необходим прием препарата 2 раза в день с обязательным введением по крайней мере одной дозы вечером, чтобы обеспечить непрерывный сон. Десмопрессин также применяют внутривенно при лечении гемофилии вследствие его необъяснимой способности усиливать действие фактора фон Вилленбранда.
Избыток минералокортикостероидов
Избыток минералокортикостероидных гормонов — важная, но нечастая причина артериальной гипертензии. Как и при других синдромах избытка гормонов, причины его следующие:
- первичная повышенная выработка минералокортикостероидов надпочечниками;
- вторичный избыток минералокортикостероид-регулирующего гормона ангиотензина II из-за повышенной выработки ренина и ангиотензина.
Вторичный избыток минералокортикостероид-регулирующего гормона обычно возникает на фоне таких заболеваний почек, как стеноз почечной артерии, ослабляющий способность почек адекватно реагировать на изменения системного артериального давления. При умеренном избытке минералокортикостероидов преобладает сосудосуживающее действие ангиотензина II.
Первичный избыток минералокортикостероидов обычно возникает при альдостерон-вырабатывающей аденоме или при гиперчувствительности к ангио-тензину II, ведущей к двусторонней гипертрофии гломерулярной области (идиопатический альдостеронизм). Хирургическая резекция альдостерон-вырабатывающей аденомы часто полностью приводит давление крови в норму, но при идиопатическом альдостеронизме даже удаление обоих надпочечников гипертензию не устраняет.
Избыток минералокортикостероидов увеличивает внеклеточный объем Na+
В результате увеличения внеклеточного Na+ и косвенной стимуляции выработки вазопрессина, вызываемой избытком минералокортикостероидов, вода перемещается из внутриклеточного пространства и увеличивается объем внеклеточной жидкости. По мере роста циркулирующего объема жидкости и почечной перфузии в почках возникает натрийурез и увеличивается вывод Na+. Эффекты минералокортикостероидно-зависимой задержки Na+ и натрийуреза уравновешиваются при достаточно низком уровне увеличения объема жидкости и не прогрессируют до появления явного избытка объема жидкости (т.е. отеков). Сывороточная концентрация Na+ остается в норме, но быстро теряется К+, что приводит к гипокалиемии.
Заболевания, снижающие почечную перфузию, сокращают циркулирующий объем жидкости в результате гипоальбуминемии или снижения сердечной деятельности, приводят к прогрессивному росту Na+ и ретенции объема жидкости, которые не корректируются реакцией натрийуреза. Это объясняет появление отеков при застойной сердечной недостаточности, циррозе печени и нефротическом синдроме. Хотя уровень минералокортикостероидов в таких случаях высокий, он обусловлен физиологической реакцией на сниженную почечную перфузию.
Основное лечение альдостерон-вырабатывающей аденомы — хирургическое, но во многих наблюдениях избытка минералокортикостероидов необходима лекарственная терапия.
Спиронолактон является стероидным минералокортикостероидом и антагонистом андрогенных рецепторов. В качестве антагониста минералокортикостероидных рецепторов в периферических канальцах он оказывает калийсбере-гающее мочегонное действие, полезное при таких состояниях вторичного избытка минералокортикостероидов, как застойная сердечная недостаточность и цирроз печени.
Низкие дозы спиронолактона для пациентов с застойной сердечной недостаточностью привели к более существенному снижению показателей смертности, чем ожидалось в связи с мочегонным эффектом препарата, что дает основания предположить и другое действие минералокортикостероидов на ткани, помимо влияния на почки в регулировании работы сердечно-сосудистой системы.
Спиронолактон усваивается в форме двух активных метаболитов с длительным сроком полувыведения в плазме. Как антагонист рецептора андрогенов спиронолактон может вызвать гинекомастию и атрофию половой системы у мужчин.
Спиронолактон также применяют при лечении гирсутизма у женщин. В отличие от других антагонистов андрогенных рецепторов, нарушающих обратную связь с гипофизом и приводящих к компенсаторному повышению уровня тестостерона, спиронолактон также подавляет синтез андрогенов.
Диуретики — класс лекарственных препаратов, функционально противодействующих минералокортикостероидам в почечных канальцах и часто применяемых для лечения избытка минералокортикостероидов. Калийсберегающие мочегонные средства амилорид и триамтерен сокращают реабсорбцию Na+, не взаимодействуют с андрогенными рецепторами и не вызывают гипогонадных симптомов у мужчин. Тем не менее препараты могут вызывать гиперкалиемию, поэтому их необходимо применять под наблюдением врача.
Клиническая и лабораторная диагностика нарушений объема жидкости
- Клинические признаки увеличенного объема жидкости (отеки) свидетельствуют об избытке Na+, а признаки уменьшения объема (постуральная гипотония, дегидратация, олигурия) — о недостатке Na+
- Лабораторное подтверждение гипернатриемии отражает недостаток свободной жидкости, а подтверждение гипонатриемии — ее избытка
Избыток вазопрессина
Избыток вазопрессина — обычная причина гипокалиемии. Избыток вазопрессина может быть вызван многими причинами, в том числе вазопрессин-секретирующими опухолями, побочным действием лекарств, легочными и неврологическими заболеваниями.
Механизмы влияния этих заболеваний изучены плохо, при их наличии может высвобождаться вазопрессин, не ингибируемый низкой сывороточной осмоляльностью, в результате возникает так называемый синдром несоответствующей секреции ADH. Избыточная выработка вазопрессина ведет к задержке почками свободной жидкости. Поскольку обмен Na+ регулируется иначе, задержка жидкости приводит к гипонатриемии «разбавления».
Основная часть избыточной свободной жидкости растворяется во внутриклеточном пространстве, поэтому не происходит увеличения циркулирующего и внеклеточного объема жидкости (гипертензии и отеков соответственно). Тем не менее, небольшого увеличения внеклеточной жидкости достаточно для ренальной перфузии и увеличения вывода Na+ через почки. Увеличение вывода Na+ — не реакция на гипонатриемию, а адекватный физиологический ответ на увеличенный циркулирующий объем жидкости.
Лечение повышенной выработки вазопрессина обычно сводится к устранению основной причины этого состояния. В некоторых случаях при выработке вазопрессина под влиянием неврологических заболеваний или новообразований необходима лекарственная терапия и ограничение потребления воды. Антибиотики тетрациклиновой группы, такие как демеклоциклин, противодействуют влиянию вазопрессина на почки, но могут быть нефротоксичными. Как это ни парадоксально, мочегонные средства улучшают состояние гипонатриемии, вероятно уменьшая почечный медуллярный осмотический градиент для свободной реабсорбции воды.
ЛЕКАРСТВА, ВЛИЯЮЩИЕ НА ЭНДОКРИННУЮ РЕГУЛЯЦИЮ РЕПРОДУКТИВНОЙ СИСТЕМЫ
Вопросы, относящиеся к мочеполовой системе как части репродуктивной системы, подробно изложены в Мочеполовая система.
В отличие от других систем, которые регулируют важные физиологические функции краткосрочно, гипоталамо-гипофизарно-гонадная (ГГГ) система регулирует дифференциацию вторичных половых признаков в течение всей жизни. Для поддержания сперматогенеза, развития яйцеклеток и менструального цикла нужно краткосрочное регулирование, в то время как в периоды пубертата и менопаузы — длительное.
Выработка гипоталамусом гонадотропин-рилизинг гормона, а гипофизом — гонадотропина, координируются сложными нейроэндокринными механизмами. Главный регулятор выработки полового гормона — лютеинизирующий гормон, а главный гормон, стимулирующий развитие гамет, — фолликулостимулирующий гормон. Эти гормоны вырабатываются эпизодически, или «пиковым методом». Андрогены и эстрогены ингибируют секрецию гонадотропина, но эти эффекты меняются во время менструального цикла.
Андрогены вырабатываются в гонадах и надпочечниках, а эстрогены — из предшественников андрогенов в гонадах и жировой ткани
Лютеинизирующий гормон и фолликулостимулирующий гормон стимулируют стероидогенез в половых железах и метаболизм надпочечниковых андрогенов в тестостерон и эстрогены (рис. 11.20). Синтез эстрогенов и андрогенов имеет общие биосинтетические этапы с другими адренокортикальными стероидами, но глюкокортикостероиды и минералокортикостероиды не вырабатываются в половых железах, т.к. в этих тканях не хватает нужных ферментов. В норме большинство половых стероидов продуцируются в гонадах.
Рис. 11.20 Регуляция синтеза половых гормонов. Гипоталамический гонадотропин-рилизинг гормон (GnRH) стимулирует выброс лютеинизирующего гормона (LH) и фолликулостимулирующего гормона (FSH) гонадотрофами задней доли гипофиза. LH и FSH стимулируют выработку половых гормонов в гонадах. Затем андрогены надпочечников перерабатываются в более мощные андрогены в гонадах. Ферменты ароматазы преобразовывают андрогены в эстрогены как в гонадах, так и в жировой ткани. В некоторых тканях-мишенях фермент 5а-редуктаза преобразовывает тестостерон в более мощный андроген дигидротестостерон. У взрослых мужчин половые гормоны вырабатываются постоянно. У женщин гонадотропины и половые гормоны вырабатываются по более сложной схеме во время менструального цикла (см. рис. 11.24). DHEA — дегидроэпиандростерон.
Однако при заболеваниях надпочечников выработка большого количества стероида дегидроэпиандростерона в ретикулярной зоне может привести к образованию значительного количества половых стероидов.
Дегидроэпиандростерон имеет небольшую андрогенную активность, но легко преобразуется в другие половые стероиды в гонадах, становясь источником мощных андрогенов. Дегидроэпиандростерон при оральном приеме экстенсивно конъюгируется печенью и незначительно увеличивает концентрацию активных андрогенов.
Эстрогены также образуются в результате активности фермента ароматазы в половых железах и адипоцитах. Ароматаза преобразовывает андрогены в эстрогены в жировой ткани и отвечает за основную выработку эстрогена в постменопаузе и более высокие уровни эстрогена у людей с ожирением.
Физиология женской репродуктивной системы
Яичники продуцируют половые клетки для оплодотворения и синтезируют гормоны для репродуктивных тканей и поддержания женских вторичных половых признаков
Яичник состоит из сферических фолликул в строме, окруженной мембраной и белочной оболочкой (рис. 11.21). Каждая фолликула содержит гамету (ооцит, яйцо, яйцеклетка). Первоначально в яичниках содержится около 7 млн яйцеклеток, но большая их часть погибает еще до рождения и в детстве, поэтому ко времени половой зрелости остается приблизительно 400 тыс. ооцитов; из них приблизительно 0,1% (т.е. около 400) будет овулировать. Самые важные гормоны яичника — половые стероиды эстрогены (прежде всего эстрадиол, а также эстрон и эстриол) и прогестерон. Их выработкой управляет система ГГН (рис. 11.22).
Рис. 11.21 Строение женской репродуктивной системы. Женская репродуктивная система состоит из двух яичников. Каждый яичник окружен фаллопиевыми трубами (длиной приблизительно 10 см каждая), выходящими в матку. Нижняя часть матки сужается и образует шейку, которая является мышечной структурой, содержащей секреторные железы и выходящей во влагалище. Шейка вырабатывает слизь, действующую как барьер для восходящей инфекции из влагалища в матку. Влагалище — мышечная труба из многослойного неорогове-вающего чешуйчатого эпителия. Внешние слои эпителия постоянно отмирают и формируют клеточные массы, которые используют для определения степени истощенности влагалищной слизистой оболочки, стимулирования эстрогеном и наличия инфекции или онкологического новообразования.
Рис. 11.22 Гипоталамо-гипофизарно-яичниковая система. Эндокринный контроль функций яичников осуществляют гормоны, самые важные из которых — эстроген и прогестерон. Их синтезом управляет система ГГН. Нейроны в предоптической области гипоталамуса вырабатывают декапептид, называемый гона-дотропин-рилизинг гормоном (GnRH), который поступает в гипофиз. GnRH воздействует на особые рецепторы гонадотропин-секретирующих клеток гипофиза и стимулирует пульсирующую выработку фолликулостимулирующего гормона (FSH) и лютеини-зирующего гормона (LH), которые действуют на рецепторы в яичнике и стимулируют синтез гормонов и овуляцию.
Менструальный цикл (период между двумя овуляциями) продолжается 24-32 дня
Первый день менструации начинается со сброса маточной оболочки, что занимает 3-5 дней. Этот период сопровождается фолликулярной или пролиферативной фазой менструального цикла (до середины цикла, около 14 дней), когда происходит овуляция (рис. 11.23). В фолликулярной фазе развивающиеся фолликулы вырабатывают эстрадиол, который обусловливает пролиферацию внутренней оболочки матки. Если оплодотворение не произошло, наступает лютеиновая, или секреторная, фаза, продолжающаяся также примерно 14 дней. Во время этой фазы на месте лопнувшего фолликула возникает желтое тело, вырабатывающее прогестерон.
Лютеинизирующий гормон увеличивает выработку андрогенов и прогестерона, а фолликулостимулирующий гормон — эстрогена из андрогенов
Выработкой эстрогена и прогестерона управляет система ГГН (см. рис. 11.22):
- LH увеличивает образование андростенедиона и тестостерона на рецепторах фолликулярной капсульной стенки;
- FSH вызывает ароматизацию андрогенов в эстрогены на рецепторах зернистых клеток яичника;
- в поздней фолликулярной стадии некоторые зернистые клетки яичника дифференцируются, трансформируются в клетки, содержащие LH-рецепторы, и отвечают на LH выработку прогестерона. Это первый шаг в преобразовании зернистых клеток яичника в лютеиновые клетки. Только фолликулы, обладающие этим вторым набором рецепторов, отвечают на LH и овулируют.
Лютеинизирующий гормон вызывает овуляцию, уменьшает синтез андрогенов и эстрогенов и увеличивает секрецию прогестерона
Концентрация эстрогенов в крови повышается по мере созревания фолликула. Обычно половые стероиды управляют своим синтезом путем отрицательной обратной связи с гипоталамусом и гипофизом, снижая выработку LH и FSH. Этот механизм изучен недостаточно, но эффект обратной связи в ходе цикла меняется, когда высокие концентрации эстрадиола (> 200 пг/мл) усиливают выработку LH в течение 2-дневного периода. Этот подъем уровня LH (рис. 11.24):
- уменьшает чувствительность LH-рецепторов на оболочке, таким образом подавляя синтез андрогенов и эстрогенов;
- стимулирует LH-рецепторы на дифференцированных зернистых клетках яичника, что приводит к началу выделения прогестерона;
- стимулирует возобновление мейоза в яйцеклетке. Начинается второе мейотическое деление, которое останавливается в метафазе и заканчивается при оплодотворении;
- способствует выбросу яичниковых цитокинов, активаторов профибринолизина, простагландинов и гистамина, вызывая сначала разрыв капсульной стенки, а потом сокращение окружающих ее структур, что заканчивается ее разрывом (овуляцией). Это происходит через = 36 час после стимуляции LH.
Рис. 11.24 Изменения концентрации гормонов во время менструального цикла. Концентрации гормонов могут сильно различаться. Во время менструации и в ранней фолликулярной фазе концентрации гормонов низкие, и поскольку есть небольшая отрицательная обратная связь, то выработка гонадотропина, особенно фолликулостимулирующего гормона (FSH), немного увеличена. FSH стимулирует фолликулы яичников к росту, созреванию и выработке эстрогенов. Затем увеличивающаяся концентрация эстрогена проявляет отрицательную обратную связь, уменьшая концентрации гонадотропина. Однако, когда концентрация эстрогенов достигает критического значения (> 200 пг/мл) за определенный отрезок времени (2 дня), отрицательная обратная связь переходит в положительную, и стимулируется резкий выброс из гипофиза лютеинизирующего гормона (LH) и FSH (в меньшей степени). Увеличенная концентрация LH уменьшает чувствительность LH-рецепторов в яичниках, таким образом подавляя синтез андрогенов и эстрогенов и приводя к быстрому снижению концентрации циркулирующих эстрогенов. Однако LH-рецепторы зернистых клеток продолжают реагировать на LH и начинают вырабатывать прогестерон.
Желтое тело яичника формируется после овуляции и вырабатывает прогестерон, контролирующий состояние внутренней оболочки матки
При стимуляции LH зернистые клетки лопнувшего фолликула формируют желтое тело (рис. 11.25). Оно вырабатывает большие количества 17-гидроксипрогестерона, прогестерона и эстрогена. Прогестерон необходим для регуляции состояния эндометрия. Если оплодотворение не происходит, желтое тело атрофируется и регрессирует на 21-й день менструального цикла. В поздней лютеиновой фазе уменьшающиеся концентрации прогестерона вызывают отторжение эндометрия.
После оплодотворения выработка прогестерона поддерживается повышающимися концентрациями человеческого хорионического гонадотропина. Прогестерон ингибирует менструальный цикл и, таким образом, поддерживает беременность путем:
- поддержки секреторного состояния эндометрия для развития эмбриона и плаценты;
- подавления обратной связи выработки гонадотропина;
- антиэстрогенного влияния шеечной слизи для уменьшения фертильности;
- развития молочных желез.
Заболевания, при лечении которых применяют эстрогены и антагонисты эстрогенов
Эстроген-зависимые заболевания
У женщин многие заболевания связаны с эстрогенами, но лишь немногие вызваны непосредственными изменениями их синтеза. Такие заболевания, как менструальные нарушения, неоплазия половых органов, рак молочной железы и предрасположенность к аутоиммунным заболеваниям, подвержены влиянию эстрогенов, но не вызываются их избытком или недостатком. Чрезмерная секреция эстрогенов у женщин, подобно избытку тестостерона у мужчин, не сопровождается четкими признаками или симптомами.
Терапию эстрогенами применяют для:
- компенсации уровня гормонов при недостаточности;
- подавления эндогенной выработки гормонов (противозачаточные средства);
- лечения других гормон-зависимых состояний.
ЭСТРОГЕНЫ И АГОНИСТЫ ЭСТРОГЕНА. Ежедневный синтез эстрогена (в основном эстрадиола и эстрона) в предменопаузе у женщин меняется в течение менструального цикла от 20 до 100 мг/сут. Эстрогены легко конъюгируются сульфатированием в печени и впоследствии выводятся с желчью и мочой. Печеночный метаболизм ограничивает оральную терапию эстрогеном, поэтому необходимы ежедневные введения синтетического эстрадиола в дозе 1-2 мг для адекватного замещения недостатка гормонов. Некоторые препараты эстрогенов менее восприимчивы к печеночному метаболизму:
- конъюгированные эстрогены (в основном сульфат эстрона), выделенные из мочи беременных кобыл либо синтетические эстрогены, впоследствии гидролизируются и преобразуются в более активные эстрогены в периферических тканях;
- трансдермальные пластыри с эстрогенами поставляют эстрадиол в большой круг кровообращения и увеличивают экспозицию эстрогенов в периферических тканях перед печеночным метаболизмом;
- этинилэстрадиол используют во многих оральных противозачаточных таблетках. Он содержит замену С-17 эстрадиола, уменьшаемую метаболизмом. Препарат дает мощный эстрогенный эффект в дозах 20-50 мг/сут.
Один из самых старых синтетических эстрогенов диэтилстильбэстрол является нестероидным синтетическим эстрогеном. Его использование у беременных в 1970-х гг. для предотвращения невынашивания плода привело к репродуктивным отклонениям у дочерей этих женщин и признанию долгосрочного влияния половых стероидов на плод, поэтому во время беременности противопоказано применение любого эстрогена или антиэстрогена.
Неблагоприятными эффектами эстрогенов могут быть менструальные кровотечения, задержка жидкости, тошнота, увеличение синтеза печенью гормон-связанных глобулинов, повышение уровней триглицеридов, увеличение свертываемости крови и риск возникновения рака молочной железы и матки. Повышенный риск рака матки устраняют одновременной терапией прогестероном.
ИЗБИРАТЕЛЬНЫЕ МОДУЛЯТОРЫ ЭСТРОГЕНОВЫХ РЕЦЕПТОРОВ. Роль эстрогенов в увеличении риска раковых опухолей молочных желез и матки обусловила использование нестероидных антагонистов эстрогеновых рецепторов. Как теперь стало очевидно, эти средства, называемые ранее антиэстрогенами, являются тканеизбирательными в проявлении эстрогенного эффекта (кости, жировые ткани, эндометрий, коагуляция) и антиэстрогенного эффекта (молочные железы, гипофиз). В дополнение к избирательности действия, эти средства имеют различные степени влияния на конечные эффекты агонистов эстрогенов. Тканеспецифичная активность вызывается дифференцированной связкой с факторами транскрипции тканей, затрагивающими как эстроген-рецептор-проводящую, так и неэстроген-рецептор-проводящую генную транскрипцию.
Тамоксифен — антагонист эстрогена в ткани молочных желез, частично оказывает эффекты агониста на эндометрий, мочеполовой эпителий, ремоделирование костной ткани и метаболизм холестерина. Не все эти ткани одинаково чувствительны к действию тамоксифена. Большая часть тамоксифена метаболизируется в 4-гидрокситамоксифен, активный метаболит с большей активностью. Тамоксифен и его активные метаболиты имеют длительные периоды полувыведения в плазме (5-14 дней) и подвергаются обширному окислительному метаболизму.
Тамоксифен используют в некоторых странах для лечения бесплодия, но его основное назначение — вспомогательное лечение рака молочной железы. Терапия тамоксифеном уменьшает риск повторного возникновения рака молочной железы после первичного лечения на срок до 5 лет. Некоторые случаи терапии рака молочной железы показывают влияние тамоксифена на рост других раковых клеток. Некоторые пациентки с раком молочной железы реагируют на слабый агонистический эффект тамоксифена при первичном росте опухоли — явление, называемое «вспышка тамоксифена», но он обычно длится недолго, далее превалирует эффект антагониста.
Кломифен — избирательный модулятор эстрогеновых рецепторов, используемый для лечения бесплодия и химически сходный с тамоксифеном (см. далее).
Ралоксифен — нестероидный избирательный модулятор эстрогеновых рецепторов, отличающийся по химическому строению от тамоксифена и кломифена. Ралоксифен имеет период полувыведения около 26 час, конъюгирует с глюкуронидом и выделяется с желчью. Ралоксифен первоначально был разработан для терапии рака, но впоследствии обнаружили его противорезорбтивный эффект на костную ткань у женщин в менопаузе, что сделало возможным его применение при лечении остеопороза. Ралоксифен обладает эффектом агониста эстрогена на костную резорбцию, понижение ЛПНП и на коагуляцию с другими избирательными модуляторами эстрогеновых рецепторов. Ралоксифен отличается от тамоксифена тем, что не может стимулировать эндометрий матки. Эффекты ралоксифена как антагониста эстрогена в молочных железах и гипоталамусе ведут к уменьшению риска развития рака молочной железы и «приливов» в постменопаузе.
Фармакология прогестерона
Прогестерон вырабатывается яичниками в больших количествах (10-20 мг/сут) во время лютеиновой фазы менструального цикла и яичниками и плацентой во время беременности. Гестагены используют в следующих терапевтических ситуациях:
- для контрацепции;
- при нарушениях менструального цикла;
- при эндометриозе;
- для послеродового подавления лактации. Гестагены обладают сродством к рецепторам
андрогенов, поэтому многие препараты имеют андрогенные побочные эффекты. Гестагены также имеют ограниченный аффинитет с рецепторами минералокортикостероидов и глюкокортикостероидов. В клинической практике применяют различные синтетические гестагены. Мифепристон, мощный антагонист рецептора прогестерона и глюкокортикостероидов, используют как абортивное средство.
Контрацепция и менструация
Лекарственные средства можно применять для:
- подавления женской репродуктивной функции, т.е. в целях контрацепции;
- замещения отсутствующих гормонов, коррекции нарушений секреции гормонов, облегчения зачатия или предотвращения аменореи (отсутствие менструации).
Стероидные противозачаточные средства
Существует множество оральных природных и полусинтетических эстрогенов и гестагенов (аналоги прогестерона). Главный эстроген — этинилэстрадиол, ацетилированное производное эстрадиола. Гестагены разработаны на основе модификации одной из двух молекул — 19-нортестостерона или 17-гидроксипрогестерона.
ПРОИЗВОДНЫЕ 19-НОРТЕСТОСТЕРОНА. Производные гестагена первого поколения были недостаточно эффективны и действовали андрогенно. Левоноргестрел (d-изомер норэтистерона) — представитель второго поколения гестагенов и более мощный. Сродство гестагенов первого и второго поколений к андрогенным рецепторам объясняет способность этих лекарственных средств лечить акне и снижать уровень холестерина ЛПВП. Эффект комбинированной эстроген-гестагеновой терапии на печень (липопротеины, связанные глобулины и коагуляция) представляет собой суммирование эстроген-гестагенового и андроген-связанного эстроген-антагонистического действий. Гестагены третьего поколения (дезогестрел, гестоден и норгестимат) имеют минимальную андрогенную активность и оказывают большее эстроген-агонистическое действие на холестерин и свертывание крови при условии комбинирования с эстрогенами.
ПРОИЗВОДНЫЕ 17-ГИДРОКСИПРОГЕСТЕРОНА АЦЕТАТА. Препараты не имеют андрогенной или эстрогенной активности, их используют в препаратах для в/м введения или депо-препаратах при маточном кровотечении и для контрацепции у женщин в предменопаузе. Самый часто применяемый препарат в этом классе — медроксипрогестеро-на ацетат, оральный препарат, обычно используемый в комбинированной заместительной гормональной терапии.
Комбинированные оральные контрацептивы
Комбинированные оральные контрацептивы (КОК) включают гестагены второго и третьего поколения, комбинированные с этинилэстрадиолом (табл. 11.20). Комбинация эстрогена и гестагена оказывает следующие эффекты:
- гестагены подавляют менструальный цикл, воздействуя на гипоталамус и гипофиз;
- гестагены делают слизь шейки матки непроходимой для спермы;
- эстрогены активируют гестагеновые рецепторы и увеличивают чувствительность к прогестерону;
- эстрогены противодействуют андрогенному действию синтетических гестагенов;
- эстрогены вносят вклад в отрицательную обратную связь с гипоталамусом и гипофизом.
Комбинированные оральные контрацептивы обычно принимают 21 день, потом делают перерыв на 7 дней, чтобы прошло кровотечение (монофазный препарат). Монофазный препарат можно принимать ежедневно в течение 12 нед (т.е. 4 пачки) до 7-дневного перерыва, особенно если есть неблагоприятные эффекты в течение недели без таблеток. Трехфазные препараты обеспечивают три ступенчатых изменения дозировок эстрогенов и гестагенов, подражая естественному фону циклической выработки стероидов. Для минимизации побочных эффектов были разработаны таблетки с низкой дозой эстрогена (20 мкг этинилэстрадиола) и комбинированные с антиандрогенными прогестогенами (ципротерона ацетат). Побочные эффекты КОК: маточные кровотечения, тошнота, головная боль, мигрень, дискомфорт в молочных железах, увеличенный риск тромбоза глубоких вен. Первые КОК содержали более 50 мкг этинилэстрадиола, что приводило к повышенному риску цереброваскулярных и сердечно-сосудистых заболеваний. В настоящее время рекомендованная доза этинилэстрадиола составляет 20-35 мкг, которая не увеличивает риск возникновения сердечнососудистых заболеваний при отсутствии других факторов риска типа курения, пожилого возраста и диабета.
Преимущества КОК заключаются в подавлении менструального цикла и наступлении эндокринного состояния, подобного беременности или лактации, что обеспечивает:
- эффективную контрацепцию (0,5 беременности на 100 человеко-лет);
- уменьшение встречаемости и/или серьезности предменструального напряжения, дисменореи, аменореи и анемии;
- улучшение состояния кожи при акне (некоторые препараты);
- подавление доброкачественных заболеваний молочных желез;
- подавление кист яичников;
- уменьшение риска рака яичников;
- возможное подавление эндометриоза;
- подавление фибром матки;
- уменьшение риска воспалительных заболеваний малого таза, связанное, возможно, с утолщением слоя маточной слизи до такой степени, что бактерии не могут проникнуть в репродуктивный тракт.
Практика применения комбинированных оральных контрацептивов
На рис. 11.26 показано, что относительный риск побочных эффектов стероидных контрацептивов (по сравнению с другими рисками) небольшой и меньше, чем риск наступления беременности. Побочный эффект этих препаратов связан со следующим:
- дозы эстрогена более 50 мг, особенно для курящих пациентов, могут способствовать увеличению риска развития сердечно-сосудистых заболеваний. Большинство современных препаратов содержит 35 мг эстрогена или меньше. Эстроген — основная причина тромбозов, т.к. он влияет на факторы свертывания крови;
- КОК уменьшают риск рака яичников и матки, но некоторые данные дают основания предположить увеличение риска рака молочной железы;
- КОК нарушают переносимость глюкозы, особенно у лиц, предрасположенных к сахарному диабету. Состояние обычно нормализуется в течение 6 мес после прекращения применения КОК. Женщинам, входящим в группу риска, обычно назначают только гестагенные контрацептивы.
Фертильность и беременность во время и после применения КОК
- Возможность спонтанного аборта и каких-либо нарушений среди тех, кто принимал или принимает таблетки, не повышается, при этом уменьшается риск рождения мертвого плода
- У большинства женщин происходит быстрое восстановление фертильности после прекращения приема таблеток
Контрацептивы, содержащие только гестагены (минипили)
Таблетки, содержащие только гестагены (POP), принимают непрерывно; у многих женщин овуляция сохраняется, менструации идут нормально, хотя могут быть нерегулярными. В основе противозачаточной эффективности POP лежит воздействие на маточную слизь и эндометрий. POP содержат более высокую дозу гестагенов, чем КОК, из-за отсутствия синергетического взаимодействия с эстрогенами.
Депо-препараты гестагенов
К данному классу относятся внутримышечные депо медроксипрогестерона ацетата (действующие 12 нед), норэтиндрон, вводимый внутримышечно каждые 8 нед, подкожные имплантаты этинилэстрадиола, комбинированного с гестагеном, или одного гестагена. Имплантаты левоноргестрела действуют в течение 5 лет после введения. Два основных эффекта этих лекарств — уплотнение маточной слизи для предотвращения проникновения спермы и подавление овуляции в середине цикла.
Действие таких депо-препаратов обратимо, они обеспечивают чрезвычайно надежную контрацепцию (столь же эффективную, как и стерилизация) в результате стабилизации концентрации левоноргестрела в крови. Такие депо-препараты могут вызывать нерегулярные маточные кровотечения и отсроченное восстановление фертильности в некоторых случаях. Они могут усугубить депрессию и предменструальный синдром у некоторых женщин, увеличить аппетит и массу тела.
Посткоитальные контрацептивы и экстренная контрацепция
Комбинации гестагенов и эстрогенов в высоких дозах, введенные в течение 72 часов после полового акта, в 75% случаев предотвращают развитие беременности. При этом задействовано множество факторов:
- если овуляция не произошла, всплеск LH может уменьшиться, заканчиваясь ановулярным циклом;
- воздействие прогестерона на шейку матки и эндометрий уменьшает жизнеспособность спермы;
- эстрогены не дают яйцеклетке пройти через фаллопиевы трубы.
Обычный посткоитальный противозачаточный метод заключается в приеме 4 таблеток КОК (содержащих 30-35 мкг этинилэстрадиола и по крайней мере 300 мкг норгестрела или 125 мкг левоноргестрела) 2 раза в течение 72 час после полового акта. Часто появляется тошнота. Существуют экстренные противозачаточные препараты, содержащие 50 мкг этинилэстрадиола и 25 мкг левоноргестрела в каждой таблетке. Также зарегистрирован для клинического применения препарат с двумя таблетками по 75 мкг левоноргестрела. Тошноту и рвоту можно уменьшить препаратами, содержащими только гестагены.
Заместительная гормональная терапия
Заместительную гормональную терапию (ЗГТ) используют для лечения признаков дефицита эстрогенов (приливы, атрофия мочеполовых органов) и для сохранения костной ткани в менопаузе. Мочеполовые менопаузальные признаки: сухость влагалища, болезненный половой акт, рецидивирующие инфекции мочевыводящих путей, недержание мочи и атрофия слизистой оболочки мочевыводящих путей. Вазомоторные менопаузальные признаки: приливы, потливость и учащенное сердцебиение. Эти признаки прекращаются спонтанно после нескольких месяцев или лет, но могут появиться вновь. Механизмы, лежащие в основе вазомоторных нарушений во время менопаузы, еще не изучены. Недостаточность эстрогенов ведет к прогрессивной потере минеральной массы костей и коллагена в течение нескольких последующих лет, что может привести к остеопорозу (см. главу 15).
Эстроген- и прогестерон-заместительная терапия в период менопаузы
- Преимущества — снижение общей смертности, риска атеросклероза, предотвращение остеопороза, атопического вагинита и психоневрологических эффектов
- Риски — менструальное кровотечение, тромбоз вен, холестаз, болезненность груди, отеки, головные боли, повышенный риск возникновения рака молочной железы
Лекарственная терапия менопаузальных признаков
ЗАМЕСТИТЕЛЬНАЯ ГОРМОНАЛЬНАЯ ТЕРАПИЯ. Эстроген-заместительная терапия уменьшает проявления климакса и риск возникновения остеопороза. Замещение гормонов в менопаузе обычно проводят натуральными эстрогенами. Они включают специальные составы эстрадиола или конъюгированных эстрогенов, извлеченных из растений или мочи беременных кобыл. Конъюгированные препараты эстрогена содержат множественные эстрогенные вещества, включая 17β-эстрадиол, сульфат эстрона и эквилин (эстроген, не вырабатываемый человеческим организмом). Тиболон, синтетический стероид с эстрогенным и гестагенным эффектами, по имеющейся информации, улучшает состояние при дефиците эстрогенов. Фитоэстрогенсодержащие пищевые добавки с изофлавоноидами сои, клопогона кистевидного или красного клевера также уменьшают менопаузальные признаки.
При заместительной гормональной терапии только эстрогенами:
- развивается эндометриальная гиперплазия, которая может трансформироваться в опухоль;
- стимулируется рост фибромиом, что может привести к тяжелым кровотечениям.
В связи с этим эстрогены обычно комбинируют с гестагенами для подавления роста эндометрия.
Если гестаген вводят в последние 10 дней 28-дневного цикла, начинается кровотечение, поэтому эти два стероида лучше принимать вместе непрерывно. Андрогены оказывают благоприятный эффект на настроение и либидо у женщин в менопаузе, но неэффективны в противодействии влиянию эстрогенов на матку. Комбинированная терапия эстрогеном и тестостероном — наиболее адекватна у женщин после гистерэктомии. Однако результаты крупномасштабных исследований показали, что ЗГТ связана с ростом смертности, что способствовало формированию негативного отношения к ЗГТ и поиску альтернативной терапии.
НЕГОРМОНАЛЬНЫЕ МЕТОДЫ ЛЕЧЕНИЯ. Такие методы предусматривают терапию менопаузальных признаков, но не уменьшают мочеполовые симптомы и не предотвращают риск заболеваний сердечнососудистой системы. Клонидин (а2-агонист адренорецепторов) и вералиприд (антагонист дофамина) уменьшают приливы, пропранолол (антагонист β-адренорецепторов) помогает при треморе.
Нарушение выработки половых гормонов у женщин в период предменопаузы
Нарушения в работе женской репродуктивной системы иллюстрирует рис. 11.27.
Недоразвитие половой системы и бесплодие
Изолированная недостаточность гонадотропина — врожденный дефицит гонадотропин-рилизинг гормона, ведущий к гипогонадотропному недоразвитию половой системы, которое характеризуется евнухоидными чертами, неполным развитием вторичных половых признаков и аменореей. Функция гипоталамуса управляется обратной стероидной связью, но масса тела и рацион питания также имеют определенное значение. Например, начало половой зрелости (первая менструация) наступает при достижении определенной массы тела и определенного соотношения жира и мышц. Потеря массы тела более 20% или чрезмерные физические нагрузки, связанные с потерей жировой прослойки, могут вызвать аменорею или олигоменорею (редкие менструальные циклы). Это связано с низким содержанием в организме женских половых гормонов и прекращением овуляции (бесплодием), что также может привести к уменьшению костной массы.
ТЕРАПИЯ ГОНАДОТРОПИНОМ. Экзогенные гонадотропины показаны при вторичном бесплодии на фоне врожденной или приобретенной гонадотропной недостаточности. Кломифен — средство первой линии (см. далее). Если кломифен не обеспечивает овуляцию, последовательно применяют FSH и LH как гонадотропные препараты, включающие:
- человеческий менопаузальный гонадотропин из постменопаузальной мочи, который имеет биологическую активность, равную FSH и LH. Это биологический экстракт, поэтому его трудно стандартизировать;
- метродин, очищенным препарат из постменопаузальной мочи, содержит 94°/о FSH и не имеет эффектов LH;
- рекомбинантные FSH и LH;
- человеческий хорионический гонадотропин, который вырабатывается на ранних сроках беременности бластоцистами, а позднее — плацентарным синтетиотропобластом. Структурно он сходен с LH, связывается с LH-рецепторами и действует также, но имеет намного более длинный период полувыведения (20 час по сравнению с 12 мин).
Во избежание многоплодной беременности вводят низкие дозы FSH в течение 14 дней и ежедневно проводят ультразвуковую диагностику для наблюдения за ростом фолликул. Дозу увеличивают только при отсутствии созревания яйцеклеток. Можно применить такую схему терапии: в начале лечения — высокая доза FSH с пошаговым ее уменьшением как при естественном цикле выработки FSH. Другой режим заключается в подавлении эндогенной схемы выработки гонадотропина, в том числе аналогом GnRH. Этот метод дает возможность более точно контролировать дозу гонадотропина и распределения его по времени и риск уменьшает невынашивания плода.
ГОНАДОТРОПИН-РИЛИЗИНГ ГОРМОН И АНАЛОГИ ЕГО АГОНИСТА. Гонадотропин-рилизинг гормон — декапептид. Его аналоги модифицированы заместителями в 6 и 10 аминокислотах для повышения эффективности и продолжительности его действия. Используемые в настоящее время препараты — гонадорелин (собственно GnRH), бусерелин, гозерелин и лейпрорелин. Постоянное применение агонистов GnRH может, в конечном счете, подавить синтез гипофизарных гонадотропинов после периода стимуляции. Высокие уровни GnRH уменьшают чувствительность GnRH-рецепторов к гонадотропам, что ведет к гипогонадальному гипопитуарному состоянию. Ранее были предприняты попытки использовать этот эффект для контрацепции, вводя аналоги GnRH в форме назального спрея, аэрозоля и капель, однако было выявлено, что эти препараты могут вызвать выраженную эстрогенную недостаточность и, следовательно, привести к менопаузальным симптомам.
Прием рекомбинантного GnRH гонадорелина в пульсирующем режиме при дисфункции гипоталамуса
Интермиттирующий прием экзогенного GnRH стимулирует эндогенный синтез гонадотропина, сохраняет механизм обратной связи и, таким образом, предотвращает риск развития многоплодной беременности. Введение GnRH внутривенно или подкожно в таком режиме дает хорошие результаты — возобновление овуляции происходит в 90% случаев. Если зачатия не требуется, заместительную терапию можно проводить с помощью КОК, чтобы обеспечить наличие гормонов, необходимых для сохранения плотности костей и здоровых сосудов. Сильнодействующие аналоги агониста GnRH применяют для десенсибилизации, уменьшения выработки гипофизарного гонадотропина и избытка половых гормонов (см. далее).
Заболевания яичников
СИНДРОМ ПОЛИКИСТОЗНЫХ ЯИЧНИКОВ. Синдром поликистозных яичников (СПЯ) — распространенная причина бесплодия. Этот синдром ассоциируется с бесплодием, ожирением, инсулинорезистентностью, гирсутизмом и типичным гормональным профилем:
- высокий уровень LH (т.е. низкое соотношение FSH : LH);
- повышенные уровни эстрогенов и андрогенов;
- низкий уровень прогестерона.
Высокий уровень эстрогенов увеличивает риск эндометриальной карциномы, а высокий уровень андрогенов ведет к гирсутизму и возникновению акне. Лечение подбирают согласно симптомам с целью:
- предотвращения аменореи или олигоменореи и некупированного действия эстрогенов;
- индуцирования овуляции и фертильности;
- купирования вирилизирующего действия андрогенов.
Аменорея, олигоменорея и дисфункциональное маточное кровотечение лечат гестагенами, чтобы подавить действие эстрогенов. Овуляцию вызывают кломифеном или другими антиэстрогенами. Если кломифен не приводит к овуляции, показаны препараты гонадотропина, или интермиттирующий прием аналогов GnRH (см. ранее).
Кломифен применяют для лечения бесплодия у пациенток с синдромом поликистозных яичников
Кломифен — антиэстроген, противодействующий нормальной отрицательной обратной связи эндогенных эстрогенов с гипоталамусом и гипофизом, что приводит к повышенной выработке FSH, индуцирующей фолликулярный рост. Частота овуляции после приема кломифена составляет 70%, но беременность наступает только в 30% случаев. Кломифен имеет длительный период полувыведения в плазме крови и может оказать антиэстрогенное действие на матку после успешной овуляции. Препарат можно использовать как антиэстроген при раке молочной железы. Кломифен пациенты переносят хорошо, побочные эффекты (увеличение яичников и вазомоторные симптомы, например приливы и сердцебиение) отмечаются только при высоких дозах препарата или после длительного лечения.
Даназол и агонисты GnRH модулируют гонадотропную систему
Реакцией на уменьшение эстрогенов могут быть разнообразные нарушения у женщин: неоплазмы молочной железы и матки, эндометриоз, дисфункциональное маточное кровотечение и эстроген-зависимые иммунологические синдромы. Один из способов лечения — применение антагонистов эстрогеновых рецепторов, но модуляторы выработки гипофизарного FSH и LH также уменьшают синтез эстрогенов (рис. 11.28).
Рис. 11.28 Модуляция системы гонадотропина. Лекарственные средства изменяют функцию гипоталамо-гипофизарно-гонадной системы. Агонисты рецептора гонадотропина (лейпролид, нафарелин, гистрелин) десенсибилизируют гонадотрофный ответ, приводя к уменьшению концентрации лютеинизирующего гормона (LH) и фолликулостимулирующего гормона (FSH). Даназол имитирует подавление обратной связи эндогенными андрогенами и уменьшает выработку гонадотропина без выраженного андрогенного побочного действия. Антагонисты рецепторов андрогенов и эстрогенов прерывают подавление обратной связи выработки гонадотропина половыми стероидами. Повышение уровня гонадотропинов антагонистом эстрогенов кломифеном стимулирует яичниковый фолликулогенез при лечении бесплодия, тогда как рефлекторное увеличение LH антагонистом андрогенных рецепторов флутамидом может стимулировать синтез тестостерона и подавлять антиандрогенное действие. Флутамид можно комбинировать с агонистами гонадотропин-рилизинг гормона (GnRH) при лечении рака предстательной железы.
Даназол — слабый андроген, подавляющий выработку гонадотропина, что ведет к последующему сокращению синтеза эстрогенов. Хорошо себя зарекомендовали агонисты GnRH лейпролид, нафарелин и гистрелин. Эти препараты оказывают большее влияние на GnRH-рецепторы гипофиза, чем эндогенный агонист GnRH. После короткой стимуляции они уменьшают чувствительность GnRH-рецептора и, следовательно, выработку гонадотропина. Эти препараты вводят парентерально, и они вызывают побочные эффекты менопаузального типа: вазомоторные симптомы, потеря костной массы, атрофия мочеполовых органов.
Избыток андрогенов у женщин
Гирсутизм и акне часто встречаются у женщин, но не всегда связаны с избытком андрогенов. Гирсутизм — распространенный признак СПЯ. Андрогенное действие на сальную железу и волосяной фолликул вызывает преобразование пушковых волос в более жесткие и увеличивает рост волос. Устранение андрогенной стимуляции не корректирует этот процесс полностью, но предотвращает дальнейшее прогрессирование.
Стероидные антиандрогены:
- спиронолактон, антагонист альдостерона, имеющий более сильное воздействие на рецепторы андрогенов, чем ципротерон. Спиронолактон подавляет цитохром Р-450, монооксигеназы, изменяет стероидогенез, сокращая синтез тестостерона и увеличивая его метаболизм. Спиронолактон вызывает задержку калия, поэтому необходимо наблюдение;
- ципротерона ацетат действует как гестаген, что требует периодического прерывания терапии для реализации менструального кровотечения. Препарат можно применять с этинилэстрадиолом, что обеспечивает противозачаточный эффект. В США ципротерон не применяют.
Комбинированные оральные контрацептивы применяют при СПЯ-зависимом избытке андрогенов, если беременность не планируется
Нестероидные антиандрогены включают флутамид, нитуламид и ингибитор 5а-редуктазы финастерид. Они оказывают такой же эффект, что и стероидные антиандрогены при лечении избытка андрогенов у женщин.
Клинические испытания с использованием триазолидиндиона или бигуанида (метформина) как агентов повышения чувствительности к инсулину продемонстрировали ограничение избытка андрогенов при СПЯ. Агонисты GnRH уменьшают стерои-догенез в яичниках, но эти препараты пациенты переносят плохо из-за менопаузальных симптомов.
Избыток и дефицит андрогенов у мужчин
Надпочечники и яички вырабатывают различные вещества, стимулирующие андрогенные рецепторы. Дигидротестостерон и тестостерон — наиболее значимые, но предшественники типа дегидроэпиандростерона и андростенедиона также оказывают андрогенный эффект. 17-Углеродные андрогенные предшественники как надпочечников, так и гонад могут преобразовываться в тестостерон 17-гидроксистероиддегидрогеназой в яичках или яичниках. Фермент 5а-редуктаза вырабатывает сильнодействующий андрогенный дигидротестостерон в предстательной железе, коже, сальных железах и головном мозге. Из-за специфического влияния 5а-редуктазы на ткани наблюдаются такие андрогенные эффекты, как рост аденомы простаты и мужская алопеция (облысение), что в значительной степени обусловлено дигидротестостероном. Рецептор андрогенов относится к лиганд-активируемым факторам транскрипции ДНК, подобно минералокортикостероидным и другим стероидным рецепторам.
Андрогены имеют большое значение при лечении нарушений полового созревания, заболеваний простаты и гирсутизма
Избыток андрогенов у мальчиков в предпубертатный период из-за нерегулируемой выработки тестостерона в яичках (тестотоксикоз) ведет к наступлению преждевременной половой зрелости, маленькому росту взрослого мужчины и поведенческим проблемам. Задержку наступления пубертата у мальчиков-подростков можно лечить короткими курсами андрогенной терапии для стимуляции системы ГГГ. После наступления полового созревания избыток андрогенов у мужчин не проявляется, но у женщин ведет к андрогенным реакциям: от гирсутизма до вирилизации (мужеподобности). Недостаточность андрогенов у взрослых мужчин — фактор развития мужского остеопороза.
АНДРОГЕН-ЗАЛЛЕСТИТЕЛЬНАЯ ТЕРАПИЯ. Как и эстрогены, тестостерон плохо накапливается из-за метаболизма в печени. В клинической практике используют синтетические аналоги, трансдермальные пластыри и препарат для в/м введения (табл.11.21). Препараты тестостерона для в/м введения с интервалом 1 раз в 2-4 нед (энантат тестостерона, циприонат тестостерона, пропионат тестостерона) благодаря масляной транспортной основе медленно поглощаются из места инъекции в отличие от тестостерона на водной основе, вводимого с 3-дневным интервалом. Трансдермальные системы доставки тестостерона и топические гели позволяют исключить метаболизм первого прохождения через печень.
Андроген-заместительная терапия
- Препараты для в/м введения (энантат тестостерона, циприонат тестостерона, пропионат тестостерона) недороги, их можно вводить с 2-4-недельными интервалами
- Трансдермальные системы введения тестостерона очень эффективные, но дорогостоящие
- При использовании оральных андрогенов существует высокий риск возникновения заболеваний печени
Тестостерон-заместительная терапия показана мужчинам с недоразвитыми половыми признаками, что проявляется такими клиническими симптомами, как уменьшение роста волос, физической выносливости, либидо и размеров яичек, а также данными лабораторных исследований (уменьшение свободного или альбумин-связанного тестостерона). Через 4 нед тестостерон-заместительной терапии у мужчины в большинстве случаев улучшается физическая форма, сексуальная функция, настроение и липидный профиль. У здоровых мужчин высокие дозы тестостерона или синтетических андрогенов приводят к незначительному увеличению мышечной массы и физической выносливости, но увеличивают риск агрессивного поведения, приапизма, эритроцитоза, олигоспермии и ухудшения липидного профиля. О побочных эффектах на печень (печеночная киста, аденома печени и холестатические повреждения) было сказано ранее при обсуждении оральных синтетических андрогенов. У пожилых мужчин введение андрогенов повышает концентрации в сыворотке крови специфических простатических антигенов и может усугубить гипертрофию простаты.
Орально активные андрогены метилтестостерон и флуоксиместерон в андроген-заместительной терапии обычно не применяют, но ими часто злоупотребляют лица, занимающиеся бодибилдингом. Другие орально активные андрогенные стероиды (тестолактон, оксандролон, станозолон, оксиметолон) и препараты для в/м введения (нандролон) в клинической практике используют при раке и рефрактерной анемии. В течение всего периода терапии андрогенами необходимо наблюдение врача для контроля за печенью и другими разнообразными побочными эффектами (табл. 11.22).
Таблица 11.22 Эффекты терапии андрогенами
|
Центральная нервная система |
Подавление гонадотропина, поведенческие эффекты |
|
Внешний облик |
Гирсутизм, вирилизация, акне, облысение, гинекомастия |
|
Гематологические |
Эритроцитоз |
|
Метаболические |
Дислипидемия |
|
Гепатические |
Холестатическая желтуха, гепатит, гепатоцеллюлярная карцинома |
|
Мочеполовые |
Приапизм, гипертрофия простаты, рак предстательной железы |
Рис. 11.29 Антиандрогенная терапия. Эндогенный тестостерон и дигидротестостерон связывают и димеризируют цитозольные андрогенные рецепторы (AR), перемещают их к ядру и регулируют генную транскрипцию. Дигидротестостерон синтезируется из тестостерона в тканях-мишенях, которые содержат фермент 5а-редуктазу. Антагонисты андрогенов конкурентно подавляют связывание андрогенов с AR. Стероидный антиандроген спиронолактон также может подавлять синтез тестостерона. Ингибиторы 5а-редуктазы избирательно уменьшают синтез дигидротестостерона в тканях-мишенях. CRE — элемент ответа на глюкокортикостероиды.
Антиандрогенную терапию (рис. 11.29) применяют для лечения заболеваний простаты у мужчин:
- нестероидные антагонисты андрогенов (флутамид, нитуламид) действуют селективно на рецепторы тестостерона и не действуют на другие стероидные рецепторы. Использование этих препаратов способствует повышенной выработке LH и синтезу тестостерона, что может привести к нерезультативному лечению;
- гонадотропин-подавляющий гестаген мегестрола ацетата используют для уменьшения андрогенов при метастатическом раке простаты, но он не действует как прямой антагонист андрогенных рецепторов. Также для снижения уровня эндогенных андрогенов проводят орхиэктомию;
- спиронолактон, антагонист минералокортикостероидов, также является агонистом андрогена; препарат обычно используют для лечения женского гирсутизма и он не эффективен при раке простаты.
Было отмечено, что у мужчин андрогенный эффект (например, рост аденомы простаты и облысение) зависит от стимуляции андрогенных рецепторов дигидротестостероном, что привело к терапевтическому применению ингибитора 5а-редуктазы финастерида. Тестостерон преобразуется ферментом 5а-редуктазой в более сильный дигидротестостерон в коже, печени и тканях половой системы.
Финастерид эффективен при симптомах гипертрофии простаты, но в меньшей степени, чем антагонисты а-адренорецепторов.
Читайте также
- Тренировки и ускорение метаболизма
- Как ускорить обмен веществ
- Обмен веществ у детей и подростков
- Генетические факторы нарушения обмена веществ у детей
- Обмен веществ и гормоны
- Замедленный обмен веществ
- Замедление обмена веществ
- Тренировки для похудения
Литература
- Bar RS. Early diagnosis and treatment of endocrine disorders. Totowa, N.J.: Humana Press, c2003.
- DeGroot LJ. Endocrinology. Oxford Elsevier 2005.
- Melmed S, Conn PM. Endocrinology: basic and clinical principles. Totowa, N.J.: Humana Press, c2005.
- Mino-Leon D, Figueras A, Amato D, Laporte JR. Treatment of type 2 diabetes in primary health care: a drug utilization study. Annals Pharmacother 2005; 39: 441-445.
- Padwal R, Majumdar SR, Johnson JA, Varney J, McAllister FA. A systematic review of drug therapy to delay or prevent type 2 diabetes. Diabetes Care 2005; 28: 736-744. [Drug treatment of type 2 diabetes.]
- Racine Ms, Barkan AL. Medical management of growth hormone-secreting pituitary adenomas. Pituitary 2002; 5: 67-76.
- Sanders S. Endocrine and reproductive systems. London; New York; Mosby, 2003.
- Woelfle J, Chia DJ, Massart-Schlesinger MB, Moyano P, Rotwein P. Molecular physiology, pathology, and regulation of the growth hormone/insulin-like growth factor-1 system. Ped Nephrol 2005; 20: 295-302.