Сердечно-сосудистая система
Категория:
«Фармакология».
Содержание
Физиология сердечно-сосудистой системы[править | править код]
Сердечно-сосудистая система состоит из сердца и кровеносных сосудов
Сердечно-сосудистая система обеспечивает кровоснабжение тканей организма, необходимое для их нормальной деятельности, доставляя кислород и питательные вещества и удаляя продукты обмена. Нормальное парциальное давление кислорода (рO2) и двуокиси углерода (рСO2) в оксигенированной артериальной крови составляет:
- рO2 — 100 мм рт. ст.;
- рСO2 — 40 мм рт. ст.
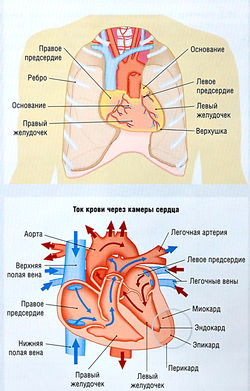
Частота сердцебиений у человека в покое равна ~ 70 уд/мин, это обеспечивает нагнетание крови 5 л/мин. Масса сердца взрослого человека равна = 300 г. Сердце состоит из 4 камер: двух предсердий (небольших по размеру, расположенных у основания органа) и двух желудочков (более крупных, расположенных у верхушки сердца) (рис. 13.1). Стенка камер сердца состоит из 3 слоев: эпикарда (наружный слой), миокарда (средний слой) и эндокарда (внутренний слой).
Клапаны сердца обеспечивают ток крови в одном направлении. Правые предсердие и желудочек получают дезоксигенированную кровь от всех частей тела и, сокрaщаясь, направляют ее через легочную артерию в легкие. Левые предсердие и желудочек получают реоксигенированную кровь через легочные вены и нагнетают ее через аорту, посылая ко всем органам и тканям. Расположение и наименование клапанов показаны на рис. 13.1.
Клапаны сердца
- Клапаны предотвращают обратный ток крови через сердце
- Атриовентрикулярные клапаны находятся между желудочками и предсердиями
- Обратный ток крови в артерии предотвращают полулунные клапаны
- Клапаны, поврежденные в результате заболеваний, например ревматической лихорадки, можно заменить искусственными клапанами
Сосудистое дерево[править | править код]
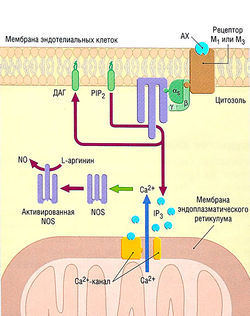
Сосудистая система человека (сосудистое дерево) состоит из кровеносных сосудов двух типов — артерий и вен. Эти сосуды выстланы изнутри эндотелиальными клетками, контактирующими с кровью. Эндотелий представляет собой не просто барьер между кровью и стенкой сосуда, он высвобождает множество важных вазоактивных веществ, например оксид азота, влияющих на диаметр сосуда и свертывание крови, тем самым осуществляя местную регуляцию кровотока (рис. 13.2).
Рис. 13.2 Пример высвобождения вазоактивных средств (здесь оксида азота) из эндотелия. Ацетилхолин (АХ), брадикинин, тромбин, серотонин, другие препараты и напряжение при стрессе могут вызывать высвобождение оксида азота (N0). АХ использует многочисленные метаболиты при клеточном ответе, которые в конечном итоге приводят к высвобождению оксида азота. 1Р3 — инозитол-1,4,5-трифосфат; NOS — синтаза оксида азота; Р1Р2 — фосфатидилинозитолдифосфат; ДАГ — диацилглицерол.
Типичное систолическое/диастолическое кровяное давление в покое равно 120/80 мм рт. ст., хотя существуют различия между отдельными субпопуляциями (например, у женщин давление часто ниже). Кровяное давление пропорционально сердечному выбросу (минутному объему сердца) и сопротивлению току крови в артериолах. Сопротивление зависит от калибра сосуда, его эластичности и геометрии, а также от вязкости крови. Артериальное кровяное давление выражается отношением систолического давления к диастолическому.
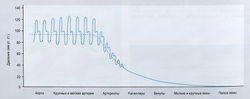
Максимальной величины давление достигает в фазу систолы, когда левый желудочек сокращается и выталкивает кровь в аорту. Минимальная величина наблюдается в фазу диастолы, когда левый желудочек расслабляется и наполняется кровью, которая возвращается в сердце (рис. 13.3).
Рис. 13.3 Кровяное давление в кровеносных сосудах различного типа. Показано систолическое и диастолическое кровяное давление, а также среднее артериальное давление [1].
В среднем давление варьирует от = 90 мм рт. ст. в артериях до = 5 мм рт. ст. в главных центральных венах. Кровяное давление промежуточной величины наблюдают в капиллярах, соединяющих артериолы и венулы.
Питательные вещества и метаболиты покидают сосудистую систему и поступают в нее через мембрану капилляров. Регуляция кровотока путем изменения диаметра кровеносных сосудов представляет собой сложный процесс. Сосудистое ложе каждого органа имеет свои особенности. Некоторые сосуды регулируются автономными нервами (например, в коже), другие подвержены ауторегуляции (в частности, сердце и скелетные мышцы). Элементом ауторегуляции является местное высвобождение вазоактивных веществ, таких как NO, из эндотелия. Сердечная мышца и гладкие мышцы сосудов обладают общими свойствами, однако имеются и различия, являющиеся жизненно важными, как мы увидим далее.
Электрофизиология сердца[править | править код]
Нормальное сердцебиение начинается в результате спонтанной деполяризации (пейсмекерная активность) в специализированных клетках синоатриального узла
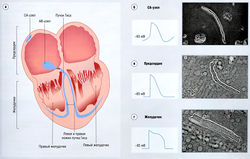
Синоатриальный (СА) узел (синусно-предсердный узел) человека в покое (рис. 13.4) ритмически генерирует импульсы с частотой ~ 70 в мин — это чаще, чем в любой другой области сердца. Узел иннервируется вегетативной нервной системой; высвобождение ацетилхолина из блуждающего нерва снижает частоту сердцебиений, тогда как норэпинефрин повышает ее. Потенциал действия СА-узла активирует клетки предсердия, которые затем проводят импульс в атриовентрикулярный (АВ) узел (предсердно-желудочковый узел). Проведение в АВ-узле запаздывает примерно на = 70 мсек вследствие малого диаметра волокон и природы ионных токов в этих клетках. Только АВ-узел обеспечивает электрическую связь предсердий и желудочков, т.е. контролирует переход потенциала действия от предсердий к желудочкам. В желудочке потенциал действия быстро передается через левую и правую ножки пучка Гиса (см. рис. 13.4), откуда распространяется по желудочку через проводящую сеть, известную как волокна Пуркинье, и в итоге достигает мышцы желудочка. Потенциалы действия СА- и АВ-узлов совершенно различны по форме (высоте и длительности импульса), поскольку вызывающие их токи (возникающие в результате открытия и закрытия ионных каналов) неодинаковы (рис. 13.5, 13.6; см. рис. 13.4).
Неодинаковое распределение ионов К+ и Na+, проходящих через мембрану клеток предсердий и желудочков, обусловливает наличие диастолического мембранного потенциала покоя от -65 до -90 мВ в клетках СА- и АВ-узлов соответственно. Диастолический мембранный потенциал в клетках СА- и АВ-узлов нестабилен, и достигаемая им величина более положительная, чем в клетках предсердий или желудочков. Мембранный потенциал покоя зависит от градиента концентрации К+. Внутри клетки концентрация К+ высокая по сравнению с внеклеточной средой, поскольку в фазу диастолы клеточная мембрана более проницаема для К+, чем для других ионов. Градиент концентрации К+ поддерживается благодаря Na+/K+-Hacocy (известному также, как Na+/K+-ATФa3a; см. главу 12). Na+/K+-насос перемещает три иона Na+ из клетки в обмен на два иона К+ (т.е. действует как электрогенный насос; рис. 13.7).
Рис. 13.4 Региональные вариации структуры клеток и конфигурации потенциала действия сердца. Потенциалы действия в различных областях сердца совершенно различны вследствие различий ионных каналов, лежащих в основе потенциалов действия в этих областях, (а) Местоположение СА- и АВ-узлов и пучка Гиса. (б) Потенциал действия из СА-узла и клетка СА-узла, (в) Потенциал действия из предсердия и клетка предсердия, (г) Потенциал действия из желудочка и клетка желудочка. АВ — 403 атриовентрикулярныи; СА — синоатриальныи.
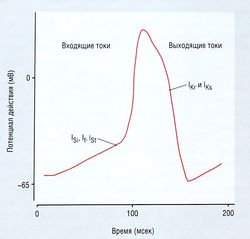
Рис. 13.5 Ионные каналы и токи (I), лежащие в основе потенциала действия синоатриального узла. Isi — входящий ток, переносимый ионами Са2+; lf — funny-ток, или активированный гиперполяризацией катионный ток, который может играть роль водителя ритма и переноситься ионами Na+ и Са2+; lSt — поддерживаемый входящий ток Na+, который может иметь значение для пейсмекерной активности; 1Кг и lKs — замедленный быстрый или медленный ток К+. Обратите внимание, что отсутствует lNa (входящий ток Na+) или 1К1 (входящий выпрямленный ток К+).
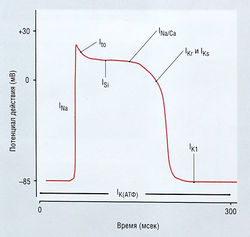
Рис. 13.6 Конфигурация типичного потенциала действия желудочка с указанием наиболее важных ионных токов. lNa — быстрый входящий ток Na+; lSi — медленный входящий ток Са2+; lt0 — кратковременный выходящий ток К+; 1Кг и 1К5 — замедленный быстрый или медленный ток К+; 1К) — входящий выпрямленный ток К+; 1К(атф> — АТФ-чувствительный ток К+; АТФ — аденозинтрифосфат. Обратите внимание, что последний из этих токов активируется только во время ишемии или гипоксии.
Натрий-зависимый потенциал действия генерируется, когда клетка предсердия или желудочка быстро деполяризуется до уровня примерно -70 мВ
Подъем потенциала действия (см. рис. 13.6) обусловлен открытием Nа+-каналов с потенциал-зависимым входом, и это открытие запускает деполяризация, в результате чего ионы Na+ перемещаются внутрь клетки (см. главу 12). Открытие Ка+-каналов носит преходящий характер, и если мембрана остается деполяризованной более нескольких миллисекунд, то канал инактивируется и входящий ток прекращается. Вследствие инактивации возникает интервал, в течение которого второй потенциал действия не может быть вызван. Этот интервал называют «эффективный рефрактерный период».
Характерная фаза плато потенциалов действия желудочка и предсердия возникает вследствие открытия Са2+-каналов L-типа и действия Na+/Ca2+-обменника. Са2+-каналы L-типа подобно Ка+-каналам являются потенциал-зависимыми, однако ток Са2+ перемещается гораздо медленнее, поэтому токи, возникающие при открытии Na+- и Са2+-каналов, получили специфические названия:
- быстрый входящий ток Na+ (INa);
- медленный входящий ток Са2+ (1Са или Isi).
В течение фазы деполяризации потенциала действия активируются другие потенциал-зависимые каналы, в особенности К+-каналы различных типов. Эти каналы переносят ионы К+ наружу, что вызывает реполяризацию мембранного потенциала.
Существуют региональные различия структуры клеток сердца и конфигурации потенциалов действия (см. рис. 13.4). Основные типы клеток сердца — это клетки узлов, клетки предсердия, клетки системы Гиса-Пуркинье и клетки желудочков (характеристики которых варьируют в зависимости от их локализации в мио-, эндо- или эпикарде). На рис. 13.4 видно, что эти клетки различаются по структуре и функции. Некоторые клетки (например, желудочков) имеют палочковидную форму и сильную исчерченность, тогда как другие (например, клетки СА-узла) напоминают полоску и слабо исчерчены. Только определенные клетки (СА- и АВ-узлов и системы Гиса-Пуркинье) деполяризуются спонтанно.
Токи К+ сердца
- Замедленный ток (1к), активируемый деполяризацией и имеющий два компонента (r и s)
- Кратковременный выходящий ток (lto), вызывающий фазу начальной реполяризации и называемый зубцом потенциала действия, который играет важную роль в некоторых, но не во всех отделах сердца
- Входящий выпрямленный ток (lki)> его основное назначение — стабилизация мембранного потенциала покоя
- АТФ-чувствительный ток (1К(атф))> который блокируется базовым уровнем АТФ и поэтому важен, когда уровень АТФ снижен (например, при такой патологии, как ишемия)
Возбуждение связано с сокращением предсердий и желудочков
Одной из наиболее важных функций потенциала действия является потенциал-зависимое раскрытие Са2+-каналов L-типа (рис. 13.6). Это приводит к относительно слабому перемещению ионов Са2+ внутрь через мембрану, относящуюся к сарколемме, которое в свою очередь активирует процесс, известный как Са2+-индуцированное высвобождение ионов Са2+. Благодаря этому из внутриклеточных депо (особенно из саркоплазматического ретикулума) высвобождается большое количество Са2+. В результате уровень внутриклеточного Са2+ возрастает от 100 нмоль в фазу диастолы до 10 мкмоль в фазу систолы. По мере возрастания концентрации цитозольный Са2+ связывается с тропонином С, регулирующим расположение филаментов актина и миозина, изменяя его таким образом, что происходит сокращение миокарда.
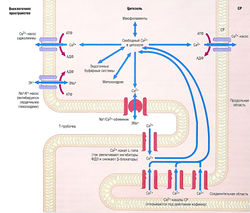
После сокращения Са2+ вновь секвестрируется в депо с помощью АТФ-зависимого Са2+-насоса, где готовится к участию в следующем цикле. Кроме того, в фазу диастолы Са2+ выходит из клетки посредством электрогенного Nа+/Са2+-обменника. На рис. 13.7 схематически показано, каким образом контролируется уровень клеточного Са2+, а также как лекарства могут модулировать эти процессы.
Рис. 13.7 Пути транспорта ионов в сердце. Особое внимание уделено перемещению Са2+ в течение сердечного цикла. Деполяризация мембраны в начале потенциала действия служит триггерным механизмом раскрытия Са2+-каналов поверхностной клеточной мембраны (сарколеммы). Повышение концентрации Са2+ внутри клетки (в цитозоле) вызывает дальнейшее высвобождение Са2+ из внутриклеточного депо (саркоплазматического ретикулума, СР). Некоторое количество Са2+ поступает также в клетку посредством Ыа+/Са2+-обменника. В цитозоле Са2+ связывается с буферными системами, включающими внутреннюю поверхность сарколеммы и контрактильный механизм (миофиламенты; на рисунке не показаны), которые активируются присутствием Са2+, что приводит к сокращению. В конце потенциала действия Са2+ покидает клетку с помощью Ма+/Са2+-обменника и АТФ-зависимого Са2+-насоса сарколеммы и возвращается в СР посредством АТФ-зависимого Са2+-насоса. АДФ — аденозиндифосфат; АТФ — аденозинтрифосфат; ФДЭ — фосфодиэстераза.
Последовательность электромеханических процессов во время одного сердечного цикла выглядит следующим образом:
- генерация импульса в СА-узле;
- деполяризация предсердия;
- сокращение правого предсердия и генерация давления, которое выталкивает кровь через открытый трехстворчатый клапан в правый желудочек;
- сокращение левого предсердия и генерация давления, которое выталкивает кровь через открытый митральный клапан в левый желудочек;
- деполяризация и сокращение левого желудочка несколько опережают сокращение правого желудочка;
- возрастающее давление в правом и левом желудочках открывает клапан легочной артерии и аортальный клапан соответственно, и кровь выталкивается в легочную артерию и аорту.
Лекарственные средства, используемые для блокады ионных токов в эксперименте
- Тетродотоксин блокирует lNa
- Никардипин блокирует lsi
- 4-Аминопиридин блокирует lto
- Дофетилид блокирует 1Кr
- Барий блокирует 1к1
- Глибурид блокирует 1К(атф)
Электрокардиограмма — запись с поверхности тела электрических изменений, возникающих в результате электрической активности сердца
Электрокардиограмма (рис. 13.8) регистрирует средний электропотенциал тела, возникающий вследствие деполяризации и реполяризации в миоцитах сердца. ЭКГ снимают с поверхности тела, используя контактные электроды.
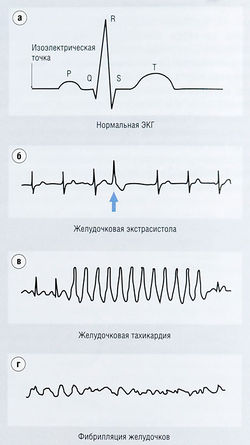
Рис. 13.8 Электрокардиограмма (ЭКГ), (а) Нормальная ЭКГ. (б) Желудочковые экстрасистолы, (в) Желудочковая тахикардия, (г) Фибрилляция желудочков. На (а) зубец Р отражает деполяризацию предсердий, QRS — деполяризацию желудочков, зубец Т — реполяризацию желудочков. Аритмии проявляются как аномалии конфигурации ЭКГ.
Нормальная ЭКГ отражает последовательность следующих процессов:
- зубец Р возникает в результате деполяризации предсердий;
- интервал PR — от начала зубца Р до начала комплекса QRS. Он соответствует времени, в течение которого волна деполяризации проходит через АВ-узел;
- комплекс QRS возникает в результате желудочковой деполяризации; реполяризация предсердий скрыта под этим большим комплексом;
- зубец Т отражает реполяризацию желудочков;
- сегмент ST — это интервал между комплексом QRS и зубцом Т. Положение выше или ниже базовой линии характерным образом изменяется во время ишемической болезни сердца (так называемое повышение или снижение сегмента ST);
- интервал QT показывает время от начала комплекса QRS до конца зубца Т и соответствует времени, необходимому для прохождения волны деполяризации и реполяризации через желудочки.
Читайте также[править | править код]
- Неотложные состояния
- Синдром спортивного сердца
- Физиологическая гипертрофия миокарда
- Патологическая гипертрофия миокарда
- Острое и хроническое перенапряжение сердца
- Спортивное сердце (лечение)
- Сердечно-сосудистая система и спорт
- Сердечно-сосудистая патология
- Механизм работы сердца
- Лечение сердечных заболеваний спортсменов
- Гипертония и спорт (повышенное артериальное давление)
- Стенокардия
- Нарушения ритма сердца и спорт
- Лечение аритмии
- Лечение инфаркта миокарда
- Хроническая сердечная недостаточность
- Гипотония (пониженное артериальное давление)
- Влияние массажа на кровеносную и лимфатическую системы
Литература[править | править код]
- Ashrafian Н, Violaris AG. Beta-blocker therapy of cardiovascular diseases in patients with bronchial asthma or COPD: The pro viewpoint. Pri Care Resp J 2005; 14: 236-241.
- ASSENT-2 Investigators. Single-bolus tenecteplase compared with front-loaded alteplase in AMI: the ASSENT-2 double-blind randomised trial. Lancet 1999; 354: 716-722.
- Baguet J-P, Robitail S, Boyer L, Debensason D, Auquier P. A meta-analytical approach to the efficacy of antihypertensive drugs in reducing blood pressure. Am J Cardiovasc Drugs 2005; 5: 131-140.
- Blasi F, Tarsia P, Cosentini R, Valenti V. Newer antibiotics for the treatment of respiratory tract infections. Curr Opin Pulm Med 2004; 10: 189-196.
- Braunwald E, Antman EM, Beasley JW et al. ACC/AHA guideline update for the management of patients with unstable angina and non-ST-segment elevation myocardial infarction-2002: summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on the Management of Patients With Unstable Angina). Circulation 2002; 106:1893-1900.
- Brown NJ. Eplerenone. Circulation 2003; 107: 2512-2518.
- Chieffo A, Stankovic G, Bonizzoni E et al. Early and mid-term results of drug-eluting stent implantation in unprotected left main. Circulation 2005; 111: 791-795.
- Cleophas TJ, Zwinderman AH. Beta-blockers and heart failure: meta-analysis of mortality trials. Int J Clin Pharm Ther 2001; 39: 383-388. [An appraisal of the topic.]
- Chobain AV, Bakris GL, Black HR et al. Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. JAMA 2003; 289: 2560-2572.
- Connolly SJ. Meta-analysis of antiarrhythmic drug trials. The American Journal of Cardiology 1999; 84(Suppl 1): 90-93.
- Domanski MJ et al. Effect of angiotensin converting enzyme inhibition on sudden cardiac death in patients following AMI. A meta-analysis of randomized clinical trials. J Am Coll Cardiol 1999; 33: 598.
- Eikelboom JW, Quinlan DJ, Mehta SR et al. Unfractionated and low-molecular-weight heparin as adjuncts to thrombolysis in aspirin-treated patients with ST-elevation acute myocardial Infarction: a meta-analysis of the randomized trials. Circulation 2005; 112: 3855-3867.
- Fiessinger JN, Huisman MV, Davidson BL et al. THRIVE Treatment Study Investigators. Ximelagatran vs low-molecular-weight heparin and warfarin for the treatment of deep vein thrombosis: a randomized trial. JAMA 2005; 293: 736-739.
- Freedman JE. Molecular regulation of platelet-dependent thrombosis. Circulation 2005; 1 12: 2725-2734. [Biology of current and future putative drug targets.]
- Caziano ТА. Cardiovascular disease in the developing world and its cost-effective management. Circulation 2005; 112: 3547-3553.
- Cluckman TJ, Sachdev M, Schulman SP, Blumenthal RS. A simplified approach to the management of non-ST-segment elevation acute coronary syndromes. JAMA 2005; 293: 349-357.
- Goldschmidt-Clermont PJ, Creager MA, Lorsordo DW, et al. Atherosclerosis 2005: Recent Discoveries and Novel Hypotheses. Circulation 2005 1 12: 3348-3353
- Healey JS, Baranchuk A, Crystal E et al. Prevention of atrial fibrillation With angiotensin-converting enzyme inhibitors and angiotensin receptor blockers: a meta-analysis. J Am Coll Cardiol 2005; 45: 1832-1839.
- Heidenreich PA et al. Meta-analysis of trials comparing beta-blockers, Ca2+ antagonists, and nitrates for stable angina. JAMA 1999; 281: 1927.
- Hiatt WR. Treatment of disability in peripheral arterial disease: new drugs. Current drug Targets. Cardiovasc Hematolog Disord 2004; 4: 227-231.
- Jabbour S, Young-Xu Y, Craboys ТВ et al. Long-term outcomes of optimized medical management of outpatients with stable coronary artery disease. Am J Cardiol 2004; 93: 294-299.
- La Rosa JC et al. Effect of statins on risk of coronary disease: a meta-analysis of randomized controlled trials. JAMA 1999; 282: 2340.
- Lawes CMM, Bennett DA, Feigin VL, Rodgers A. Blood pressure and stroke: an overview of published reviews. Stroke 2004; 35: 1024.
- LoscalzoJ. Clinical trials in cardiovascular medicine in an era of marginal benefit, bias, and hyperbole. Circulation 2005;112: 3026-3029. [An opinion on how to assimilate cardiovascular clinical trial data.]
- Martino E, Bartalena L, Bogazzi F, Braverman LE. The effects of amiodarone on the thyroid. Endocrine Rev 2001; 22: 240-254.
- Mebazaa A, Barraud D, Welschbillig S. Randomized clinical trials with levosimendan. Am J Cardiol 2005; 96(Suppl 1): 74-79 [Update on an emerging drug.]
- Patrono С, Garcia Rodriguez LA, Landolfi R, Baigent C. Drug therapy: low-dose aspirin for the prevention of atherothrom-bosis. N Engl J Med 2005; 353: 2373-2383.
- Peng H, Carretero OA, Vuljaj N et al. Angiotensin-converting enzyme inhibitors: a new mechanism of action. Circulation 2005; 1 12: 2436-2445. [An animal study that reveals a possible new explanation for some of the long term benefit with this class of drug on the heart in hypertensive patients.]
- Pitt B, White H, Nicolau J et al. Eplerenone reduces mortality 30 days after randomization following acute myocardial infarction in patients with left ventricular systolic dysfunction and heart failure. J Am Coll Cardiol 2005; 46: 425-431.
- Prandoni P. Emerging strategies for treatment of venous thromboembolism. Expert Opin Emerg Drugs 2005; 10: 87-94.
- Roccaforte R, Demers C, Baldassarre F, Teo KK, Yusuf S. Effectiveness of comprehensive disease management programmes in improving clinical outcomes in heart failure patients. A meta-analysis. Eur J Heart Failure 2005; 7: 11 33— 1144.
- Silber S. When are drug-eluting stents effective? A critical analysis of the presently available data. Z Kardiol 2004; 93: 649-663.
- Taylor AL, Wright JT Jr, Cooper RS, Psaty BM. Importance of race/ethnicity in clinical trials: lessons from the African-American Heart Failure Trial (A-HeFT), the African-American Study of Kidney Disease and Hypertension (AASK), and the Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT). Circulation 2005; 112: 3654-3666.
- Teerlink JR. Overview of randomized clinical trials in acute heart failure syndromes. Am J Cardiol 2005; 96(Suppl 1): 59-67.
- Williams B. Recent hypertension trials: implications and controversies. J Am Coll Cardiol 2005; 45: 813-827.
- Yan AT, Yan RT, Liu PP. Narrative review: pharmacotherapy for chronic heart failure: evidence from recent clinical trials. Ann Intern Med 2005; 142: 132-145.
- YusufS, Mehta SR, Xie С et al; CREATE Trial Group Investigators. Effects of reviparin, a low-molecular-weight heparin, on mortality, reinfarction, and strokes in patients with AMI presenting with ST-segment elevation. JAMA 2005; 293: 427-435.
- ↑ Principles of Anatomy and Physiology, 8th edn. by Tortora and Grabowski