Метаболический синдром
Содержание
Метаболический синдром
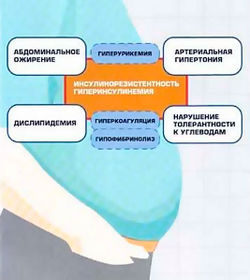
Метаболический синдром («полиметаболический синдром», «синдром изобилия», «синдром Х», «смертельный квартет», «гормональный метаболический синдром», «синдром инсулинорезистентности», «смертельный секстет», «метаболический сосудистый синдром», «дисметаболический синдром», «гипертриглицеридемическая талия», «кардиометаболический синдром»)[1] — это сочетание нарушенного углеводного обмена, абдоминального ожирения, дислипидемии и гипертензии, и связан с развитием сахарного диабета 2 типа и сердечно-сосудистых заболеваний [2].
История
В 1922 г. Г.Ф. Ланг в своих трудах отмечал наличие ассоциации артериальной гипертензии и ожирения, нарушений обмена углеводов и подагры, об этой связи доложили на Х съезде терапевтов его сотрудники А.Л. Мясников и Д.М. Гротель.
1923 г. шведский исследователь E.Kylin. впервые указал связь артериальной гипертензии (АГ) с гипергликемией и гиперурикемией.
В 1948 г. выдающийся клиницист Е.М. Тареев отмечал: « Представление о гипертонике наиболее часто ассоциируется с ожирелым гиперстеником, с возможным нарушением белкового обмена, с засорением крови продуктами неполного метаморфоза-холестерином, мочевой кислотой».
В 1966 г. связь сахарного диабета и атеросклероза описал Л.С. Шварц. В это же время J.Camus назвал сочетание у одного и того же больного сахарного диабета, дислипидемии и поражения суставов метаболическим трисиндромом.
В 1968 г. H.Mehnert и H. Kuhlman обозначили сочетание нарушения обменов как « синдром изобилия».
M. Hannefeld и W. Leonard в 1981 г. впервые сделали подробное описание метаболического синдрома. В силу существования в эпоху «холодной войны» политической тенденциозности, труды исследователей из России и стран «Восточного блока» замалчивались медицинской общественностью Запада.
В 1988 г. G. Reaven в своей Бантингской лекции, обобщив эпидемиологические, клинические и экспериментальные данные, выдвинул концепцию, в которой указал, что резистентность к инсулину, абдоминальное ожирение, АГ, дислипидемия и коронарная болезнь сердца являются проявлением единого патологического состояния, обозначенного им как « Синдром Х».
А. Regenauer в 1988 г., описывая прогностические аспекты МС, назвал его «good life syndrome», то есть « синдром благополучия» (сытости).
В 1989 г. N. Kaplan привел данные популяционных исследований, свидетельствующие о неблагоприятном жизненном и трудовом прогнозе у больных с сочетанием ожирения, сахарного диабета, АГ и коронарной болезни сердца, назвав симптомокомплекс «смертельным квартетом».
В последние годы в исследовательской и практической медицине укоренился термин «метаболический синдром», сущность его постепенно расширялась, так как стали выявляться ранее неизученные нарушения, наблюдавшиеся у части больных.
А.И.Мартынов в 2000 г. отнес к ним повышенное содержание фибриногена, уровня «малых» липопротеинов, ингибитора-1 активатора плазминогена и микроальбуминурию[3].
Результатом совместной работы ведущих международных организаций по изучению МС явилось создание нового определения. В настоящее время для установления диагноза необходимо наличие трех из пяти нижеперечисленных критериев.
![]() Критерии метаболического синдрома: IDF, NHLBI, AHA, WHF, IAS, IASO, 2009 г.
Критерии метаболического синдрома: IDF, NHLBI, AHA, WHF, IAS, IASO, 2009 г.
Любые 3 из перечисленных:
- Абдоминальное ожирение (данные, специфичные для отдельных стран и популяций)
- Триглицериды 1,7 ммоль/л (150 мг/дл) или медикаментозная терапия гипертриглицеридемии
- Снижение ЛПВП: у мужчин: <1,0 ммоль/л (40 мг/дл), у женщин: <1,3 ммоль/л (50 мг/дл) или медикаментозная терапия дислипидемии
- Повышенный уровень АД 130/85 мм рт. ст. или прием антигипертензивной терапии пациентом с артериальной гипертензией в анамнезе
- Повышенный уровень гликемии натощак 100 мг/дл или прием сахароснижающей терапии.
Роль ожирения в развитии метаболического синдрома
По материалам Фремингемского исследование было установлено, что у больных с артериальной гипертонией отмечена значительная частота метаболических нарушений: гиперхолестеринемия и гиперинсулинемия (80% обследованных), гиперурикемия (25%), сахарный диабет (15%). Было также отмечено, что у одного и того же больного часто наблюдается сочетание ожирения, артериальной гипертонии и сахарного диабета II типа[4] . Кроме того, указанное исследование позволило выделить ожирение как независимый фактор риска сердечно-сосудистых заболеваний, для которых характерна высокая смертность, особенно женщин[5].
Выделяют два типа ожирения, различающихся по локализации скоплений жировой ткани, - андроидный и гиноидный.
- Абдоминальное (висцеральное) ожирение — один из основных клинических симптомов метаболического синдрома, которое является важным фактором риска сердечно-сосудистых и других заболеваний (рис. 1), сахарного диабета II типа и ранних проявлений атеросклероза[6]. Андроидный тип характеризуется гипертрофией адипоцитов и обычно наблюдается у лиц зрелого возраста. Избыточное отложение жира происходит в области верхней половины туловища, живота. Растет масса висцерального жира. Этот тип ожирения обычно называют центральным или абдоминальным, а также «яблочным».
Kissebah A. и Bjorntorp P. показали[7], что при одинаковом показателе индекса массы тела (ИМТ) абдоминальное ожирение сопровождается более высоким риском развития сопутствующих заболеваний, чем периферическое ожирение.Именно поэтому выраженность осложнений ожирения является более высокой у мужчин, чем у женщин[8].
- При гиноидном типе ожирения (периферическое) происходит гиперплазия жировых клеток, так как он обычно развивается в детстве и наблюдается в течение всей жизни. Гиноидный тип характеризуется преимущественным отложением жира в области ягодиц и бедер, поэтому его называют ягодично - бедренным, или грушевидным.
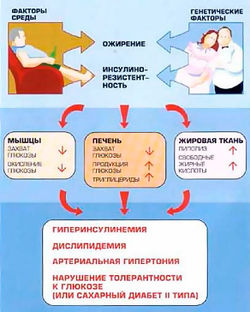
При развившемся андроидном ожирении с возрастом больного повышается активность центров гипоталамуса и снижается их чувствительность к влияниям с периферии. Последовательность развития нарушений, составляющих метаболический синдром, представляется следующим образом: ожирение - инсулинорезистентность - гиперинсулинемия - артериальная гипертензия - атеросклероз - коронарная болезнь сердца - сахарный диабет II типа[9].
Инсулинорезистентность в развитии метаболического синдрома
Развитие гипертрофического ожирения провоцирует снижение чувствительности периферических тканей к действию инсулина. Именно развитие хронического избытка инсулина в крови большинство исследователей считают “пусковой кнопкой” для возникновения всех заболеваний, входящих в понятие "метаболический синдром"[10](рис.2).
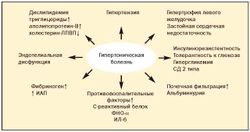
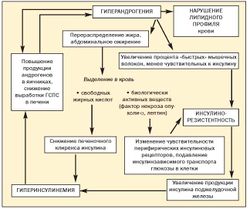
До настоящего времени не прекращается дискуссия о первичности или вторичности инсулинорезистентности и гиперандрогении при метаболическом синдроме (рис. 3)[11].
Первая гипотеза
ИР — полигенная патология, в развитии которой могут иметь значение мутации генов субстрата инсулинового рецептора (IRS-1 и IRS-2), β3-адренорецепторов, разобщающего протеина (UCP-1), а также молекулярные дефекты белков сигнального пути инсулина (глюкозные транспортеры). Особую роль играет снижение чувствительности к инсулину в мышечной, жировой и печеночной тканях, а также в надпочечниках.
В миоцитах нарушаются поступление и утилизация глюкозы, в жировой ткани развивается резистентность к антилиполитическому действию инсулина. Интенсивный липолиз в висцеральных адипоцитах приводит к выделению большого количества свободных жирных кислот (СЖК) и глицерина в портальный кровоток. Поступая в печень, СЖК, с одной стороны, становятся субстратом для формирования атерогенных липопротеидов, а с другой — препятствуют связыванию инсулина с гепатоцитом, потенциируя ИР. ИР гепатоцитов ведет к снижению синтеза гликогена, активации гликогенолиза и глюконеогенеза. Долгое время ИР компенсируется избыточной продукцией инсулина, поэтому нарушение гликемического контроля манифестирует не сразу. Но, по мере истощения функции β-клеток поджелудочной железы, наступает декомпенсация углеводного обмена, сначала в виде нарушенных гликемии натощак и толерантности к глюкозе (НТГ), а затем и сахарного диабета 2 типа (Т2СД). Дополнительное снижение секреции инсулина при МС вызывается длительным воздействием высоких концентраций СЖК на β-клетки (так называемый липотоксический эффект). При имеющихся генетически обусловленных дефектах секреции инсулина развитие Т2СД значительно ускоряется[12].
Вторая гипотеза
Согласно другой гипотезе, ведущую роль в развитии и прогрессировании инсулинорезистентности играет жировая ткань абдоминальной области. Особенность висцеральных адипоцитов — высокая чувствительность к липолитическому действию катехоламинов и низкая к антилиполитическому действию инсулина.
Помимо веществ, непосредственно регулирующих липидный обмен, жировая клетка продуцирует эстрогены, цитокины, ангиотензиноген, ингибитор активатора плазминогена-1, липопротенлипазу, адипсин, адинопектин, интерлейкин-6, фактор некроза опухолей-α (ФНО-α), трансформирующий фактор роста В, лептин и др.
ФНО-α способен воздействовать на инсулиновый рецептор и транспортеры глюкозы, потенциируя инсулинорезистентность, и стимулировать секрецию лептина. Лептин («голос жировой ткани») регулирует пищевое поведение, воздействуя на гипоталамический центр насыщения; повышает тонус симпатической нервной системы; усиливает термогенез в адипоцитах; подавляет синтез инсулина; воздействует на инсулиновый рецептор клетки, снижая транспорт глюкозы. При ожирении наблюдается лептинорезистентность. Полагают, что гиперлептинемия оказывает стимулирующее действие на некоторые гипоталамические релизинг-факторы (РФ), в частности на АКТГ-РФ. Так, при МС часто отмечается легкий гиперкортицизм, который играет определенную роль в патогенезе МС[13].
Лечение метаболического синдрома
Читайте основную статью: Лечение метаболического синдрома
Читайте также
Источники
- ↑ Бурова СА. Метаболический синдром: патогенез, клиника, диагностика, подходы к лечению. РМЖ 2001;2(9):56—62.
- ↑ Метаболический синдром: аргументы «за» и «против» Учамприна В.А.1, Романцова Т.И., Калашникова М.Ф.ГБОУ ВПО Первый Московский государственный медицинский университет им. И.М. Сеченова 2012г
- ↑ Колопкова Т. А. и др. МЕТАБОЛИЧЕСКИЙ СИНДРОМ Х-ПАНДЕМИЯ XXI ВЕКА //Саратовский научно-медицинский журнал. – 2008. – Т. 4. – №. 3.
- ↑ Hubert H. B. et al. Obesity as an independent risk factor for cardiovascular disease: a 26-year follow-up of participants in the Framingham Heart Study //Circulation. – 1983. – Т. 67. – №. 5. – С. 968-977.
- ↑ Колопкова Т. А. и др. МЕТАБОЛИЧЕСКИЙ СИНДРОМ Х-ПАНДЕМИЯ XXI ВЕКА //Саратовский научно-медицинский журнал. – 2008. – Т. 4. – №. 3.
- ↑ Ruderman N., Flier J. S. Chewing the Fat--ACC and Energy Balance //Science. – 2001. – Т. 291. – №. 5513. – С. 2558-2559.
- ↑ Kissebah A. H., Krakower G. R. Regional adiposity and morbidity //Physiological Reviews. – 1994. – Т. 74. – №. 4. – С. 761-811.
- ↑ БО Ш., САВЕЛЬЕВА Л. В. КОМПЛЕКСНЫЙ ПОДХОД К ЛЕЧЕНИЮ ОЖИРЕНИЯ И МЕТАБОЛИЧЕСКОГО СИНДРОМА У МУЖЧИН //Ожирение и метаболизм. – 2009. – №. 4.
- ↑ ДЗГОЕВА Ф. Х. Висцеральное ожирение-ключевое звено метаболического синдрома //Ожирение и метаболизм. – 2004. – №. 1.
- ↑ Благосклонная Я. В., Шляхто Е. В., Красильникова Е. И. Метаболический сердечно-сосудистый синдром //Рус. мед. журн. – 2001. – Т. 9. – №. 2. – С. 67œ70.
- ↑ Оганов М. Эпидемиологические аспекты метаболического синдрома. – 2004.
- ↑ Мамедов М. Н. Метаболический синдром: практические аспекты диагностики и лечения в амбулаторных условиях //Москва. – 2005.
- ↑ Адашева Т. В., Демичева О. Ю. Метаболический синдром–основы патогенетической терапии //Лечащий врач. – 2003. – Т. 10. – С. 24-28.