L-карнитин: научный обзор — различия между версиями
Sint (обсуждение | вклад) (→Читайте также) |
Krash (обсуждение | вклад) |
||
| (не показано 5 промежуточных версий этого же участника) | |||
| Строка 1: | Строка 1: | ||
== L-карнитин и его производные в спортивной медицине == | == L-карнитин и его производные в спортивной медицине == | ||
'''Авторы''': д.м.н. [[Александр Дмитриев]], врач-эндокринолог [[Участник:Алексей_Калинчев|Алексей Калинчев]] | '''Авторы''': д.м.н. [[Александр Дмитриев]], врач-эндокринолог [[Участник:Алексей_Калинчев|Алексей Калинчев]] | ||
| − | |||
== Введение == | == Введение == | ||
| − | [[L-карнитин|Карнитин]] впервые был обнаружен в экстрактах мышечной ткани и выделен в 1905 году. Его химическая структура (3-гидрокси-4-N-триметил-аминомасляная кислота - 3- hydroxy-4-N-trimethyl-aminobutyric acid) установлена в 1927 году, а название «карнитин» дано от латинского слова «carno» (мясо). L-карнитин и его модификации – одни из наиболее часто применяемых [[Пищевые добавки|пищевых добавок]] (БАДов) в спорте для улучшения физической формы и снижения отрицательного воздействия оксидативного стресса | + | [[L-карнитин|Карнитин]] впервые был обнаружен в экстрактах мышечной ткани и выделен в 1905 году. Его химическая структура (3-гидрокси-4-N-триметил-аминомасляная кислота - 3- hydroxy-4-N-trimethyl-aminobutyric acid) установлена в 1927 году, а название «карнитин» дано от латинского слова «carno» (мясо). L-карнитин и его модификации – одни из наиболее часто применяемых [[Пищевые добавки|пищевых добавок]] (БАДов) в спорте для улучшения физической формы и снижения отрицательного воздействия оксидативного стресса<ref>Miklos A., Ciulea L., Vari C.E. et al. The efficiency and safety of L-carnitine and caffeine after short- and long-term administration. Palestrica of the third millennium – Civilization and Sport, 2016, 17(3): 229–232.</ref><ref>Sung D.J., Kim S., Kim J. et al. Role of l-carnitine in sports performance: Focus on ergogenic aid and antioxidant. Sci and Sports, 2016, [Epub ahead of print]. doi:10.1016/j.</ref>. В то же время, доказательная база по целому ряду направлений ([[Эргогенные средства|эргогенное действие]] при [[Аэробные нагрузки|аэробных]] и [[Анаэробные упражнения|анаэробных нагрузках]], у нетренированных и тренированных атлетов, в программах снижения веса и коррекции [[Состав тела|состава тела]] и т.д.) весьма неоднородна и противоречива. |
| − | Отношение к пищевым добавкам L-карнитина в спортивной нутрициологии было сформулировано в 2010 году Международным Обществом Спортивного Питания (ISSN) в программной экспертной статье R.B.Kreider и соавторов. Карнитин традиционно входил в группу веществ, используемых для контроля веса. Многочисленные исследования последних лет показали, что пищевые добавки L-карнитина не повышают содержание карнитина в мышцах, не нормализуют содержание жиров, и не улучшают аэробную и анаэробную физическую готовность у лиц с избыточным весом даже в сочетании с тренировочными программами. Карнитин оказывает умеренное влияние на маркеры оксидативного стресса в процессе физических нагрузок. Тем не менее, некоторые исследования показали, что карнитин может помочь в ситуации продолжительных интенсивных нагрузок у тренированных атлетов (профессионалов и любителей) при переходе на более высокий уровень спортивной формы. Эта же позиция подтверждена Американской Коллегией Спортивного Питания в 2013 году. За период 2014- | + | Отношение к [[Пищевые добавки: научный подход|пищевым добавкам]] L-карнитина в спортивной нутрициологии было сформулировано в 2010 году [[Журнал интернационального общества спортивного питания|Международным Обществом Спортивного Питания (ISSN)]] в программной экспертной статье R.B.Kreider и соавторов<ref>Kreider R.B., Wilborn C.D., Taylor L. et al. ISSN exercise and sport nutrition review: research and recommendations. J.Intern.Soc.Sports Nutr., 2010, 7:7-50.</ref>. Карнитин традиционно входил в группу веществ, используемых для контроля веса. Многочисленные исследования последних лет показали, что пищевые добавки L-карнитина не повышают содержание карнитина в мышцах, не нормализуют содержание жиров, и не улучшают [[Аэробные способности|аэробную]] и [[Анаэробные лактатные способности|анаэробную физическую готовность]] у лиц с [[Избыточный вес: вред для здоровья|избыточным весом]] даже в сочетании с тренировочными программами. Карнитин оказывает умеренное влияние на маркеры оксидативного стресса в процессе физических нагрузок. Тем не менее, некоторые исследования показали, что карнитин может помочь в ситуации продолжительных интенсивных нагрузок у тренированных атлетов (профессионалов и любителей) при переходе на более высокий уровень спортивной формы. Эта же позиция подтверждена Американской Коллегией Спортивного Питания в 2013 году. За период 2014-2020 годов проведены исследования, которые несколько изменили эту позицию. Так, карнитин отдаляет момент наступления физической [[Утомление и утомляемость|усталости]] и снижает накопление [[лактат]]а в мышцах. В 2015 году показано, что при 2-х недельном приеме карнитина в дозе 2 г/сутки усиливаются антиоксидантные возможности организма до и после тренировок и снижаются показатели маркеров [[Микротравмы мышц|мышечных повреждений]]. Таким образом, если использовать карнитин не для контроля веса, а для повышения устойчивости к высоким физическим нагрузкам у тренированных спортсменов, то он проявляет активность. Ниже будут подробно рассмотрены отдельные физиологические свойства карнитина в организме спортсменов и лиц, ведущих активный образ жизни. |
== Химическая структура и фармакокинетика L-карнитина при приеме внутрь == | == Химическая структура и фармакокинетика L-карнитина при приеме внутрь == | ||
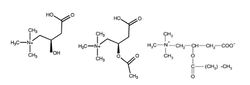
[[Image:Karnitin_Ris_1.jpg|250px|thumb|right|Рис.1. Химическая структура наиболее популярных пищевых добавок L-карнитина: L-карнитин (слева), ацетил-L-карнитин (в центре) и пропионил-L-карнитин (справа)]] | [[Image:Karnitin_Ris_1.jpg|250px|thumb|right|Рис.1. Химическая структура наиболее популярных пищевых добавок L-карнитина: L-карнитин (слева), ацетил-L-карнитин (в центре) и пропионил-L-карнитин (справа)]] | ||
| − | Подробное изучение фармакокинетики L-карнитина при приеме внутрь проведено A.M.Evans и соавторами ( | + | Подробное изучение фармакокинетики L-карнитина при приеме внутрь проведено A.M.Evans и соавторами<ref>Evans A.M., Fornasini G. Pharmacokinetics of L-carnitine. Clin.Pharmacokinet., 2003, 42(11):941-967.</ref>. Как известно, у человека пул эндогенного карнитина, включающий свободный L-карнитин и линейку коротко-, средне- и длинноцепочечных эфиров, формируется и поддерживается абсорбцией L-карнитина из пищи (регулярная диета обеспечивает 2-12 мкмол/кг/день<ref>El-Hattab A.W., Scaglia F. Disorders of carnitine biosynthesis and transport. Mol.Genet.Metab., 2015, 116(3):107-112.</ref>), биосинтезом в организме из [[Незаменимые аминокислоты|незаменимых аминокислот]] [[лизин]]а и [[метионин]]а (дает дополнительно 1,2 мкмол/кг/день L-карнитина) и экстенсивной канальцевой [[Реабсорбция в почках|реабсорбцией]] этого вещества в почках. В указанных процессах имеет значение градиент концентраций ткани/плазма крови, которая критически зависит от окисления жирных кислот. Абсорбция L-карнитина после перорального приема происходит частично за счет трансмембранного транспорта (переноса) и, особенно, за счет пассивной диффузии. После приема внутрь дозы 1-6 г, абсолютная [[Биодоступность и скорость всасывания|биодоступность]] составляет 5-18% соответственно дозе. В противоположность этому, биодоступность карнитина из пищи достигает 75%. Таким образом, фармакологические и пищевые добавки L-карнитина абсорбируются менее эффективно, чем соответствующие маленькие количества, представленные в обычной диете. |
| + | |||
| + | L-карнитин и его короткоцепочечные эфиры не связываются с белками плазмы крови и, хотя эритроциты содержат L-карнитин, его распределение между эритроцитами и плазмой происходит крайне медленно. После внутривенного введения начальный объем распределения составляет 0,2-0,3 л/кг, что соответствует объему внеклеточной жидкости. Существует по крайней мере три четких фармакокинетических компартмента для L-карнитина, причем пул карнитина в [[Сердце|миокарде]] и [[Скелетные мышцы|скелетных мышцах]] является самым медленно балансирующимся. L-карнитин выводится из организма в основном через почки. В исходном состоянии почечный клиренс L-карнитина составляет 1-3 мл/мин, что меньше скорости гломерулярной фильтрации. Это доказывает наличие для этого вещества экстенсивной канальцевой реабсорбции (98-99%). Пороговая концентрация для тубулярной реабсорбции (на уровне которой фракционная реабсорбция начинает снижаться) составляет около 40-60 мкмол/л, что сходно с эндогенным уровнем L-карнитина в плазме. Поэтому почечный клиренс L-карнитина возрастает после его экзогенного введения, приближаясь по величине к скорости гломерулярной фильтрации после внутривенного введения в высоких дозах. Пациенты с первичным дефицитом карнитина (очень редкие состояния) имеют нарушения в обмене карнитина в почках и/или транспорте его в мышечную ткань. Сходным образом, при многих формах вторичного дефицита карнитина (примером является длительное, более 2-3 недель, применение [[Мельдоний|мельдония]] – [[милдронат]]а, или ХБП) возникает нарушение почечной тубулярной реабсорбции. Пациенты в конечной стадии ХБП, находящиеся на диализе, имеют вторичный дефицит L-карнитина из-за неограниченной потери карнитина через диализат, а сам карнитин в этой ситуации используется для лечения. | ||
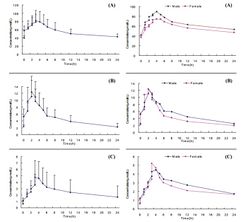
[[Image:Karnitin_Ris_2_i_3.jpg|250px|thumb|right|Рис.2 (левые графики А, В и С) – кривые средних концентраций L-карнитина (А), ацетил-L-карнитина (В) и пропионил-L-карнитина (С) после приема одиночной дозы 2 г L-карнитина. По оси абсцисс – время (час). Рис.3 (правые графики А, В и С) – сравнительные кривые средних концентраций L-карнитина (А), ацетил-L-карнитина (В) и пропионил-L-карнитина (С) после приема одиночной дозы 2 г L-карнитина у мужчин и женщин. Из Y.Cao и соавт. (2009).]] | [[Image:Karnitin_Ris_2_i_3.jpg|250px|thumb|right|Рис.2 (левые графики А, В и С) – кривые средних концентраций L-карнитина (А), ацетил-L-карнитина (В) и пропионил-L-карнитина (С) после приема одиночной дозы 2 г L-карнитина. По оси абсцисс – время (час). Рис.3 (правые графики А, В и С) – сравнительные кривые средних концентраций L-карнитина (А), ацетил-L-карнитина (В) и пропионил-L-карнитина (С) после приема одиночной дозы 2 г L-карнитина у мужчин и женщин. Из Y.Cao и соавт. (2009).]] | ||
| − | Как известно, в организме L-карнитин трансформируется в ацетил-L-карнитин и пропионил-L-карнитин. Кроме того, сами эти производные используются в качестве самостоятельных пищевых добавок. Поэтому в работе Y.Cao и соавторов ( | + | Как известно, в организме L-карнитин трансформируется в ацетил-L-карнитин и пропионил-L-карнитин. Кроме того, сами эти производные используются в качестве самостоятельных пищевых добавок. Поэтому в работе Y.Cao и соавторов<ref>Cao Y., Wang Y-X., Liu Ch-J. Comparison of pharmacokinetics of L-carnitine, AcetylL-carnitine and Propionyl-Lcarnitine after single oral administration of L-carnitine in healthy volunteers. Clin.Invest.Med., 2009; 32 (1): E13-E19.</ref> исследована фармакокинетика L-карнитина при однократном приеме внутрь в дозе 2 грамма (средняя стандартная доза) с отслеживанием изменений концентраций L-карнитина и двух его метаболитов (ацетил-L-карнитина и пропионил-L-карнитина) в плазме крови. 12 молодых здоровых участников (6 мужчин и 6 женщин, средний возраст 27,7 года, вес 62,9 кг, рост 167 см) принимали L-карнитин в разовой дозе 2 грамма в виде водного раствора. Пробы крови брались до приема карнитина, а также каждые 30 минут после приема (до 24 часов). Базовые концентрации L-карнитина и образующихся в организме в процессе метаболизма ацетил-L-карнитина и пропионил-L-карнитина в плазме крови приведены в таблице 1. Образцы мочи брались в следующие временные интервалы: 0~2 час, 2~4 час, 4~8 час, 8~12 час, 12~24 час. |
'''Таблица 1. Исходные значения концентрации L-карнитина, ацетил-L-карнитина и пропионил-L-карнитина в плазме крови участников исследований фармакокинетики Y.Cao и соавторов''' (2009). | '''Таблица 1. Исходные значения концентрации L-карнитина, ацетил-L-карнитина и пропионил-L-карнитина в плазме крови участников исследований фармакокинетики Y.Cao и соавторов''' (2009). | ||
| Строка 48: | Строка 49: | ||
! !! L-карнитин !! Ацетил-L-карнитин !! Пропионил-L-карнитин | ! !! L-карнитин !! Ацетил-L-карнитин !! Пропионил-L-карнитин | ||
|- | |- | ||
| − | | | + | | Т<sub>1/2</sub>α (час) || 1.6±1.2 || -------- || -------- |
|- | |- | ||
| − | | | + | | Т<sub>1/2</sub> (час) || 60.3±14.9 || 35.9±28.9 || 25.7±30.3 |
|- | |- | ||
| V1/F(L) || 116.5±38.3 || 615.4±261.9 || 1163.5±1707.6 | | V1/F(L) || 116.5±38.3 || 615.4±261.9 || 1163.5±1707.6 | ||
| Строка 62: | Строка 63: | ||
| Ka(h-1) || 0.8±0.9 || 18.5±19.7 || 0.9±0.7 | | Ka(h-1) || 0.8±0.9 || 18.5±19.7 || 0.9±0.7 | ||
|- | |- | ||
| − | | | + | | t<sub>1/2</sub>Ka(h) || 1.0±0.8 || 0.6±0.6 || 1.2±0.9 |
|- | |- | ||
| Tmax(h) || 3.4±0.5 || 2.4±0.7 || 3.8±0.8 | | Tmax(h) || 3.4±0.5 || 2.4±0.7 || 3.8±0.8 | ||
|- | |- | ||
| − | | Cmax(μmol·L-1) || 84.7±25.2 || 12.9±5.5 || 5.1±3.1 | + | | Cmax(μmol·L<sup>-1</sup>) || 84.7±25.2 || 12.9±5.5 || 5.1±3.1 |
|} | |} | ||
| − | ''Примечания'': | + | ''Примечания'': Т<sub>1/2</sub>α (час) – время распределения ½ введенного вещества; Т<sub>1/2</sub> (час) – биологическое время полураспада; V1/F(л) – пероральный объем распределения в центральном компартменте; CL/F(л·час<sup>-1</sup>) – пероральный клиренс из центрального компартмента; AUC(0-t) (мкмол/л/час) – площадь под кривой «время-концентрация»; AUC(0-∞)(мкмол/л/час) - ; Ka – константа скорости абсорбции; Т<sub>1/2</sub>Ka(час) – полувремя абсорбции; Tmax(час) – время достижения максимальной концентрации; Cmax(мкмол/л) – максимальная концентрация. |
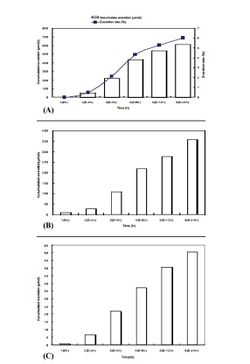
[[Image:Karnitin_Ris_4.jpg|250px|thumb|right|Рис.4. Аккумулированные показатели экскреция с мочой L-карнитина (A), ацетил-карнитина (B), пропионил-карнитина (С) и скорость экскреции L-карнитина с мочой (А) после приема одиночной дозы 2 г L-карнитина. Y.Cao и соавт. (2009). По оси абсцисс – фиксированные временные промежутки взятия проб мочи (час).]] | [[Image:Karnitin_Ris_4.jpg|250px|thumb|right|Рис.4. Аккумулированные показатели экскреция с мочой L-карнитина (A), ацетил-карнитина (B), пропионил-карнитина (С) и скорость экскреции L-карнитина с мочой (А) после приема одиночной дозы 2 г L-карнитина. Y.Cao и соавт. (2009). По оси абсцисс – фиксированные временные промежутки взятия проб мочи (час).]] | ||
| − | Как видно из таблицы 1, между мужчинами и женщинами не отмечено различий в базовых концентрациях карнитина и его метаболитов. Из графиков на рисунках 2 и 3 также видно отсутствие гендерных различий в динамике концентраций карнитина, ацетил-карнитина и пропионил-карнитина в плазме крови после приема 2 г L-карнитина во время всего периода исследования. Корреляционный анализ выявил достоверную связь между изменениями концентраций L-карнитина и ацетил-L-карнитина, L-карнитина и пропионил-L-карнитина, а также ацетил-L-карнитина и пропионил-L-карнитина. 24-часовая аккумулированная экскреция L-карнитина с мочой (613,5±161,7 мкмол) была выше таковой для ацетил-L-карнитина (368,3±134,8 мкмол, P<0.01)) и пропионил-L-карнитина (61,3±37,8 мкмол, P<0.01) (рис.4). Скорость выведения L-карнитина с мочой составила в среднем 6,1% в течение 24 часов после приема внутрь. Анализируя полученные данные (таблица 2), авторы делают следующие выводы: 1) после приема 2 г L-карнитина доминирующим метаболитом в течение всего периода наблюдения остается сам L-карнитин, максимальная концентрация которого и площадь под кривой «концентрация-время» значительно выше, чем ацетил-L-карнитина и пропионил-L-карнитина ( примерно в 7 и 17 раз, соответственно; 2) отсутствуют гендерные различия в фармакокинетике L-карнитина и его метаболитов; 3) L-карнитин в плазме крови живет дольше, чем его метаболиты (примерно в 1,5-2,5 раза); 4) тонкий кишечник – основное место абсорбции L-карнитина, а сам процесс всасывания характеризуется медленным поступлением в слизистую кишечника, длительным накоплением в этих тканях и постепенным поступлением в кровяное русло (2-2,5 часа). После перорального приема пищевых добавок максимальная концентрация L-карнитина достигается через 3-4 часа; 5) имеется корреляция между изменениями концентрации всех трех аналогов карнитина в плазме крови, что свидетельствует о направленности метаболизма L-карнитина с образованием ацетил-L-карнитина и пропионил-L-карнитина уже в процессе всасывания в кишечнике. Как уже отмечалось выше, всасывание L-карнитина в виде пищевых добавок происходит медленнее и в меньших объемах, чем в составе пищи | + | Как видно из таблицы 1, между мужчинами и женщинами не отмечено различий в базовых концентрациях карнитина и его метаболитов. Из графиков на рисунках 2 и 3 также видно отсутствие гендерных различий в динамике концентраций карнитина, ацетил-карнитина и пропионил-карнитина в плазме крови после приема 2 г L-карнитина во время всего периода исследования. Корреляционный анализ выявил достоверную связь между изменениями концентраций L-карнитина и ацетил-L-карнитина, L-карнитина и пропионил-L-карнитина, а также ацетил-L-карнитина и пропионил-L-карнитина. 24-часовая аккумулированная экскреция L-карнитина с мочой (613,5±161,7 мкмол) была выше таковой для ацетил-L-карнитина (368,3±134,8 мкмол, P<0.01)) и пропионил-L-карнитина (61,3±37,8 мкмол, P<0.01) (рис.4). Скорость выведения L-карнитина с мочой составила в среднем 6,1% в течение 24 часов после приема внутрь. Анализируя полученные данные (таблица 2), авторы делают следующие выводы: 1) после приема 2 г L-карнитина доминирующим метаболитом в течение всего периода наблюдения остается сам L-карнитин, максимальная концентрация которого и площадь под кривой «концентрация-время» значительно выше, чем ацетил-L-карнитина и пропионил-L-карнитина ( примерно в 7 и 17 раз, соответственно; 2) отсутствуют гендерные различия в фармакокинетике L-карнитина и его метаболитов; 3) L-карнитин в плазме крови живет дольше, чем его метаболиты (примерно в 1,5-2,5 раза); 4) тонкий кишечник – основное место абсорбции L-карнитина, а сам процесс всасывания характеризуется медленным поступлением в слизистую кишечника, длительным накоплением в этих тканях и постепенным поступлением в кровяное русло (2-2,5 часа). После перорального приема пищевых добавок максимальная концентрация L-карнитина достигается через 3-4 часа; 5) имеется корреляция между изменениями концентрации всех трех аналогов карнитина в плазме крови, что свидетельствует о направленности метаболизма L-карнитина с образованием ацетил-L-карнитина и пропионил-L-карнитина уже в процессе всасывания в кишечнике. Как уже отмечалось выше, всасывание L-карнитина в виде пищевых добавок происходит медленнее и в меньших объемах, чем в составе пищи<ref>Rebouche C.J. Quantitative estimation of absorption and degradation of a carnitine supplement by human adults. Metabolism, 1991, 40:1305-1310.</ref>. Кроме того, только 6,3% дозы L-карнитина, принятой внутрь, обнаруживается в моче в неизмененном виде, а 34% представлено метаболитами, преимущественно [3H]-триметиламин-N-оксидом. 22% выводятся с фекалиями, в основном в виде γ-бутиробетаина. Эти данные и выводы о фармакокинетике L-карнитина при однократном приеме в стандартной дозе 2 г/день полезны для установления режимов нутритивно-метаболической поддержки (НМП) спортсменов как с помощью самого L-карнитина, так и популярных пищевых добавок его производных – ацетил-L-карнитина и пропионил-L-карнитина. |
| − | + | === Режим приема === | |
| − | Для планирования НМП с использованием аналогов L-карнитина важен режим приема в течение дня. В работе C. Herzmann и соавторов | + | Для планирования НМП с использованием аналогов L-карнитина важен режим приема в течение дня. В работе C. Herzmann и соавторов<ref>Herzmann C., Whiting S.J., Thomas M. Pharmacokinetics of Acetyl-L-Carnitine Given in Single or Multiple Doses to HIV-1 Infected Patients with Toxic Peripheral Polyneuropathy. The Open AIDS J., 2008, 2: 39-42.</ref> показано, что однократный прием ацетил-L-карнитина в дозе 3 г/день и двукратный прием этого же вещества по 1,5 г 2 раза в день, дают одинаковый подъем концентрации метаболитов L-карнитина в плазме крови. Таким образом, не имеет принципиального значения, принимать ли L-карнитин однократно или два раза в день. |
[[Image:Karnitin_Ris_5.jpg|250px|thumb|right|Рис.5. Динамика концентрации карнитина в плазме крови (мкмол/л, ось ординат, графики слева) и почечная экскреция карнитина (мкмол карнитин/мкмол креатинин, ось ординат, графики справа) при курсовом 3-х месячном приеме L-карнитина (ось абсцисс) в дозе 2 г 2 раза в день молодыми здоровыми средней тренированности мужчинами. Черные кружки – общий карнитин, белые – свободный карнитин. Из S.Wachter и соавт. (2002).]] | [[Image:Karnitin_Ris_5.jpg|250px|thumb|right|Рис.5. Динамика концентрации карнитина в плазме крови (мкмол/л, ось ординат, графики слева) и почечная экскреция карнитина (мкмол карнитин/мкмол креатинин, ось ординат, графики справа) при курсовом 3-х месячном приеме L-карнитина (ось абсцисс) в дозе 2 г 2 раза в день молодыми здоровыми средней тренированности мужчинами. Черные кружки – общий карнитин, белые – свободный карнитин. Из S.Wachter и соавт. (2002).]] | ||
| − | Еще одним важным аспектом фармакокинетики L-карнитина и его аналогов является определение режимов курсового применения, поскольку, как считает ряд экспертов, положительные эргогенные свойства L-карнитина проявляются не сразу (при однократном приеме), а постепенно (от 2-3 недель до 2-3 месяцев применения). В работе S. Wachter и соавторов | + | Еще одним важным аспектом фармакокинетики L-карнитина и его аналогов является определение режимов курсового применения, поскольку, как считает ряд экспертов, положительные эргогенные свойства L-карнитина проявляются не сразу (при однократном приеме), а постепенно (от 2-3 недель до 2-3 месяцев применения). В работе S. Wachter и соавторов<ref>Wachter S., Vogt M., Kreis R. et al. Long-term administration of L-carnitine to humans: effect on skeletal muscle carnitine content and physical performance. Clinica Chimica Acta, 2002, 318: 51 – 61.</ref> исследовано влияние ежедневного приема L-карнитина в дозе 2 г 2 раза в день в течение 3-х месяцев на концентрации L-карнитина в плазме крови и скелетных мышцах, а также состав тела и показатели физической готовности у молодых средней тренированности мужчин. В исследовании применялся [[Велоэргометрия|велоэргометрический тест]] в течение 10 минут при 20%, 40% и 60% индивидуальной максимальной рабочей нагрузке (Pmax) до истощения. Как видно из рис.5, 3-х месячный прием L-карнитина приводил к достоверному удвоению концентраций как общего L-карнитина в плазме крови, так и свободного L-карнитина. Полное восстановление исходных концентраций L-карнитина происходило в течение 2-х месяцев после прекращения приема пищевой добавки. Динамика изменений почечной экскреции практически полностью повторяет динамику изменений L-карнитина в плазме крови. Однако, эти явные и достоверные фармакокинетические изменения в крови и моче не сопровождались значимыми изменениями ни физических показателей (VO<sub>2</sub>max, RERmax, и Pmax), ни увеличением концентрации L-карнитина в мышечной ткани или возрастанием активности митохондриальных ферментов цитрат синтазы и цитохромоксидазы и пролиферации митохондрий, ни изменениями состава мышечных волокон (по результатам биопсии мышц). Авторы делают заключение, что ''курсовое 3-х месячное применение L-карнитина в дозе 2 г 2 раза в день удваивает оборот L-карнитина в организме, но этот процесс не приводит к соответствующим сдвигам в биохимии и физиологии скелетных мышц, способствующим проявлениям эргогенного эффекта L-карнитина''. Следовательно, ''эргогенное действие L-карнитина и его аналогов, проявляющееся при их курсовом приеме у определенной категории спортсменов высшей квалификации при интенсивных пролонгированных тренировках, не может быть объяснено только накоплением L-карнитина в скелетных мышцах и последующей активизацией митохондриальных процессов.'' |
== Фармакодинамика (механизмы действия) L-карнитина == | == Фармакодинамика (механизмы действия) L-карнитина == | ||
| − | В соответствии с имеющимися представлениями | + | В соответствии с имеющимися представлениями<ref>Evans А.M., Guthrie N., Pezzullo J. Efficacy of a novel formulation of L-Carnitine, creatine, and leucine on lean body mass and functional muscle strength in healthy older adults: a randomized, double-blind placebo-controlled study. Nutrition and Metabolism, 2017, 14:7-22.</ref> L-карнитин – условно незаменимая аминокислота, - обнаруживается преимущественно в скелетных мышцах<ref name="Reuter">Reuter S.E., Evans A.M. Carnitine and acylcarnitines: pharmacokinetic, pharmacological and clinical aspects. Clin.Pharmacokinet., 2012, 51(9):553–572.</ref>, и эндогенно синтезируется в [[Печень|печени]] и [[Почки|почках]] человека<ref>Steiber A., Kerner J., Hoppel C.L. Carnitine: a nutritional, biosynthetic, and functional perspective. Mol.Aspects Med., 2004, 25(5–6):455–473.</ref>. L-карнитин необходим для энергетического метаболизма жиров, белков и углеводов<ref name="Reuter" />. Главная его роль заключается в транспорте длинноцепочечных жирных кислот к матрице митохондрий для последующего бета-окисления<ref name="Reuter" />. Кроме того, L-карнитин увеличивает биосинтез [[протеин]]ов за счет сбережения использования [[Аминокислоты|аминокислот]] для продукции энергии<ref>Owen K.Q., Jit H., Maxwell C.V. et al. Dietary L-carnitine suppresses mitochondrial branched chain ketoacid dehydrogenase activity and enhances protein accretion and carcass characteristics of swine. J.Anim.Sci., 2001, 79(12):3104–3112.</ref>. L-карнитин также подавляет гены, ответственные за деградацию протеинов в скелетной мускулатуре<ref>Keller J., Ringseis R., Koc A. et al. Supplementation with l-carnitine downregulates genes of the ubiquitin proteasome system in the skeletal muscle and liver of piglets. Animal., 2012, 6(1):70–78.</ref>, и снижает конъюгаты мышечного RING-finger protein-1 (MuRF1 – новый ген миоцитов) и убиквитин-протеинa, участвующих в катаболизме белков, и увеличивает уровни IGF-1 и Akt1<ref>Keller J., Couturier A., Haferkamp M. et al. Supplementation of carnitine leads to an activation of the IGF-1/PI3K/Akt signalling pathway and down regulates the E3 ligase MuRF1 in skeletal muscle of rats. Nutr.Metab.(Lond). 2013, 10(1):28.</ref>. Таким образом, ''множественная направленность влияния L-карнитина на внутриклеточные процессы, выявленная в последние несколько лет, не позволяет однозначно трактовать метаболические эффекты этой аминокислоты только с позиции изменения жирового обмена и бета-окисления жирных кислот в митохондриях'' (см. в разделе «Фармакокинетика» отсутствие связи повышенного экзогенного поступления L-карнитина, изменения внутриклеточных концентраций L-карнитина и свойств мышечных волокон, и проявлений эргогенных свойств). Противоречивость клинических данных в спортивной нутрициологии о действии L-карнитина (наличие или отсутствие эргогенного эффекта в различных исследованиях) также может быть обусловлена попытками однозначной трактовки данных в связи с регулированием обмена липидов. Общая схема метаболизма L-карнитина представлена на рис.6<ref>Балыкова Л.А., Ивянский С.А., Пиксайкина О.А., Ефимова Ю.А. Обоснование использования L-карнитина в спортивной медицине. Спортивная медицина: наука и практика. 2011, 1:22-30.</ref>. |
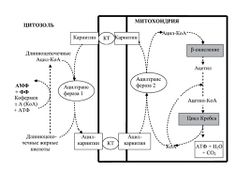
[[Image:Karnitin_Ris_6.jpg|250px|thumb|right|Рис.6. Фармакодинамика L-карнитина в организме. Из Л.А.Балыкова и соавт. (2011).]] | [[Image:Karnitin_Ris_6.jpg|250px|thumb|right|Рис.6. Фармакодинамика L-карнитина в организме. Из Л.А.Балыкова и соавт. (2011).]] | ||
| − | Метаболизм L-карнитина исследован достаточно подробно (рис.6). Традиционно важная роль отводится бета-окислению жирных кислот с последующим увеличением доступности АТФ для выполнения механической работы | + | Метаболизм L-карнитина исследован достаточно подробно (рис.6). Традиционно важная роль отводится бета-окислению жирных кислот с последующим увеличением доступности [[АТФ]] для выполнения механической работы<ref>Gorostiaga E.M., Maurer C.A., Eclache J.P. Decrease in respiratory quotient during exercise following L-carnitine supplementation. Int.J.Sports Med., 1989, 10:169.</ref>. Процесс бета-окисления состоит в последовательном укорочении цепочек жирных кислот с продукцией ацетил-CoA. Поскольку активированные длинноцепочечные жирные кислоты не способны проникать через внутреннюю митохондриальную мембрану, процесс укорочения их цепи обязательно предшествует их карнитин-зависимому транспорту в митохондриальное трансмембранное пространство. Процесс начинается с образования ацил-коэнзима А (acyl-CoA) с помощью ацил-коэнзим А-синтетазы (LCAS), которая локализуется в наружной митохондриальной мембране. Далее в процесс включаются потенциал-зависимые анионные каналы, через которые осуществляется активное движение жирных кислот. На этом этапе жирные кислоты подвергаются воздействию ацил-карнитина с ферментом CPT-I, который также находится на наружной митохондриальной мембране. Продукты этой реакции – эфиры карнитина, - транспортируются в митохондриальную матрицу посредством ряда биохимических реакций. Внутри матрицы эфиры ацил-карнитина трансформируются в соответствующие эфиры коэнзима А. Бета-окислительный процесс жирных кислот с очень длинной цепью происходит главным образом в пероксисомах, в то время как длинноцепочечные жирные кислоты окисляются и в пероксисомах и в митохондриях. Продукты окисления (включая промежуточные) окончательно метаболизируют до СО<sub>2</sub> и воды. ''Пищевые добавки L-карнитина усиливают окисление жирных кислот в мышцах с получением [[АТФ: научный обзор|АТФ]], что может отсрочить использование гликогена мышечных клеток и, тем самым, отдалить начало развития усталости при физических нагрузках. В этом заключается гипотетический механизм эргогенного гликоген-сберегающего действия L-карнитина, который, как предполагается, переключает получение энергии из углеводного на жировой источник. Такой механизм может (опять же теоретически) увеличивать выносливость (отдалять наступление усталости).'' |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
== Дефицит карнитина в организме, изменение физических показателей и потенциальная роль мельдония в спорте == | == Дефицит карнитина в организме, изменение физических показателей и потенциальная роль мельдония в спорте == | ||
=== Мельдоний и дефицит L-карнитина === | === Мельдоний и дефицит L-карнитина === | ||
| − | '' | + | : ''Основная статья:'' [[Мельдоний]] |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | '''N-триметил-гидразин-3-пропионат''' (N-trimethyl-hydrazine-3-propionate (THP или милдронат) – аналог [[карнитин]]а, который используется в определенных странах в качестве [[Кардиопротекторы|кардиопротекторного препарата]]. В то же время, это вещество специально применяется в экспериментальных условиях для создания искусственного дефицита карнитина в организме (модель вторичного дефицита карнитина) за счет угнетения OCTN2 и g-бутиробетаин-гидроксилазы – последнего фермента в биосинтезе карнитина в клетках<ref>Vaz F.M., Wanders R.J. Carnitine biosynthesis in mammals. Biochem.J., 2002, 361,417–429.</ref>. Хроническое применение THP у крыс в течение 2-3 недель снижает содержание карнитина в печени, сердце, плазме крови и скелетных мышцах на 70–80%<ref>Spaniol M., Brooks H., Auer L. et al. Development and characterization of ananimal model of carnitine deficiency. Eur.J.Biochem, 2001, 268,1876–1887.</ref>. Это снижение ассоциировано с развитием печеночного стеатоза<ref>Spaniol M., Kaufmann P., Beier K. et al. Mechanisms of liver steatosis in rats with systemic carnitine deficiency due to treatment with trimethylhydraziniumpropionate. J.Lipid.Res., 2003, 44, 144–153.</ref>, с нарушением функции миокарда<ref>Zaugg C.E., Spaniol M., Kaufmann P. et al. Myocardial function and energy metabolism in carnitine-deficient rats. Cell.Mol.Life Sci., 2003, 60,767–775.</ref>, сократительной способности ряда скелетных мышц и их атрофией<ref>Roberts P. A., Bouitbir J., Bonifacio A. et al. Contractile function and energy metabolism of skeletal muscle in rats with secondary carnitine deficiency. Am.J.Physiol.Endocrinol.Metab., 309, E265–E274.</ref>. Однако, до настоящего времени не было ясно, связаны ли эти патологические органические изменения при хроническом приеме [[милдронат]]а со снижением функциональной способности скелетной мускулатуры, как результата вторичного дефицита карнитина. Кроме того, было не ясно, повреждает ли дефицит карнитина функцию мышечных митохондрий и/или митохондриальный биогенез. Известно, что у спортсменов (особенно высокой квалификации) длительный прием [[L-карнитин]]а улучшает показатели физической готовности и функцию митохондрий<ref>Huertas R., Campos Y., Díaz E. et al. Respiratory chain enzymes in muscle of endurance athletes: effectof L-carnitine. Biochem.Biophys.Res.Commun., 1992, 188,102–107.</ref>. Для ответа на поставленные вопросы проведено франко-швейцарское экспериментальное исследование, результаты которого опубликованы в 2016 году J.Bouitbir и соавторами<ref>Bouitbir J., Haegler P., Singh F. Impaired Exercise Performance and Skeletal Muscle Mitochondrial Functionin Rats with Secondary Carnitine Deficiency. Frontiers in Physiology, 2016, 7(345): 1-13.</ref>, посвященное оценке влияния вторичного дефицита карнитина, вызываемого хроническим приемом милдроната (ТНР), на способность переносить физические нагрузки и функцию митохондрий. Авторы пришли к заключению, что дефицит карнитина, вызываемый хроническим приемом милдроната (ТНР), сопровождается снижением толерантности к физическим нагрузкам в эксперименте. Механизмами падения мышечной функции под влиянием милдроната являются: нарушение транспорта электронов, снижение функции и атрофия митохондриальной ДНК скелетных мышц в условиях окислительного стресса. Таким образом, милдронат не только не может являться допингом в спорте, но и потенциально противопоказан активно тренирующимся лицам. Включение мельдония в [[Список сильнодействующих веществ применяемых в спорте|список запрещенных субстанций WADA]] является типичной ошибкой, основанной на широком применении этого вещества атлетами ряда стран с целью улучшения восстановления после интенсивных тренировок. Те немногочисленные работы в спортивной нутрициологии с применением мельдония (милдроната), выполнены много лет назад на малой выборке, без соблюдения необходимых условий исследования пищевых добавок, и с точки зрения доказательной медицины относятся к категории «D» (самый низкий уровень). Несмотря на десятилетия использования мельдония в спорте, не было предпринято никаких усилий по комплексной оценке его эргогенных, восстановительных и иных эффектов. Однако, постоянное присутствие мельдония в крови отдельных спортсменов и целых команд, вызвало обоснованные подозрения антидопинговых структур. Это привело к созданию методик определения вещества в организме и последующему включению в список запрещенных субстанций<ref>World antidoping code international standard, Prohibited List, 2017.</ref>, несмотря на отсутствие доказательств стимуляции физических кондиций атлетов. | |
| − | |||
| − | |||
== L-карнитин и функция мозга == | == L-карнитин и функция мозга == | ||
| − | Единственной формой L-карнитина, способной проникать через гемато-энцефалический барьер (ГЭБ) является [[Ацетил-L-карнитин|ацетил L-карнитин]] (ALC). Поэтому при создании продуктов, имеющих конечной целью улучшение деятельности ЦНС, используется ацетил-L-карнитин, или, для воздействие сразу на несколько звеньев регуляции гомеостаза, – комбинация ацетил L-карнитина с другими формами. Роль ацетил L-карнитина в мозге заключается в улучшении когнитивных функций. Давно известно сходство его структуры с нейромедиатором | + | Единственной формой L-карнитина, способной проникать через гемато-энцефалический барьер (ГЭБ) является [[Ацетил-L-карнитин|ацетил L-карнитин]] (ALC). Поэтому при создании продуктов, имеющих конечной целью улучшение деятельности ЦНС, используется [[ацетил-L-карнитин]], или, для воздействие сразу на несколько звеньев регуляции гомеостаза, – комбинация ацетил L-карнитина с другими формами. Роль ацетил L-карнитина в мозге заключается в улучшении когнитивных функций. Давно известно сходство его структуры с [[Нейромедиаторы|нейромедиатором]] [[ацетилхолин]]ом и способность стимулировать рецепторы последнего<ref>Falchetto S., Kato G., Provini L. The action of carnitines on cortical neurons. Can.J.Physiol.Pharmacol., 1971, 49: 1–7.</ref>. Подробный анализ транспорта и роли ALC в мозге дан в обзоре K.A.Nałezcz и соавторов<ref>Nałezcz K.A., Miecz D., Berezowski V., Cecchelli R. Carnitine: transport and physiological functions in the brain. Molecular Aspects of Medicine, 2004, 25:551–567.</ref>. ALC как фармаконутриент применяется при лечении хронических нейродегенеративных заболеваний, в частности [[Болезнь Альцгеймера (препараты)|болезни Альцгеймера]]. Кроме ALC, проникающего из крови через ГЭБ, имеется внутримозговой синтез ALC<ref>Wawrzenczyk A., Nałezcz K.A., Nałezcz M.J. Effect of externally added carnitine on the synthesis of acetylcholine in rat cerebral cortex cells. Neurochem.Int., 1995, 26: 635–641.</ref>. Снижение содержания ALC в мозге ухудшает когнитивные функции и требует прямой или непрямой коррекции дефицита. Однако, на сегодняшний день практически нет данных о влиянии L-карнитина на функции мозга при физических нагрузках. А одних теоретических обоснований с точки зрения доказательных принципов спортивной нутрициологии недостаточно для создания рекомендаций. |
== Готовые формы БАДов с L-карнитином == | == Готовые формы БАДов с L-карнитином == | ||
| − | В распоряжении спортивных нутрициологов имеется достаточно большое число различных форм L-карнитина и его комбинаций с другими нутриентами: L-карнитин (основная форма), ацетил-L-карнитин, пропионил L-карнитин, глицин пропионил-L-карнитин, L-карнитина тартрат, L-карнитина фумарат. L-карнитин наиболее удобен для жидких вариантов БАДов, но в составе капсул и таблеток он может впитывать влагу из воздуха и приводить к порче продукта. Крупные производители развивают более стабильные формулы, наиболее подходящие для таблеток и капсул – L-карнитина тартрат и фумарат. Новой интересной патентованной формулой является ацетил L-карнитин аргината дигидрохлорид (acetyl-L-carnitine arginate dihydrochloride) с молекулярно связанной аминокислотой аргинином (коммерческое наименование АргиноКарн (ArginoCarn®). С точки зрения развития эргогенных свойств и непрямой донации оксида азота наиболее перспективной считается пока недостаточно изученная формула глицин пропионил-L-карнитина гидрохлорид | + | В распоряжении спортивных нутрициологов имеется достаточно большое число различных форм L-карнитина и его комбинаций с другими нутриентами: L-карнитин (основная форма), ацетил-L-карнитин, пропионил L-карнитин, глицин пропионил-L-карнитин, [[L-карнитин тартрат|L-карнитина тартрат]], L-карнитина фумарат. L-карнитин наиболее удобен для жидких вариантов БАДов, но в составе капсул и таблеток он может впитывать влагу из воздуха и приводить к порче продукта. Крупные производители развивают более стабильные формулы, наиболее подходящие для таблеток и капсул – L-карнитина тартрат и фумарат. Новой интересной патентованной формулой является ацетил L-карнитин аргината дигидрохлорид (acetyl-L-carnitine arginate dihydrochloride) с молекулярно связанной аминокислотой аргинином (коммерческое наименование АргиноКарн (ArginoCarn®). С точки зрения развития эргогенных свойств и непрямой донации оксида азота наиболее перспективной считается пока недостаточно изученная формула глицин пропионил-L-карнитина гидрохлорид. На сочетании нескольких формул строится структура коммерческих продуктов L-карнитина у многих ведущих компаний. |
== Заключение == | == Заключение == | ||
| − | В процессе физических нагрузок наблюдается снижение концентрации L-карнитина в плазме крови и мышечной ткани, пропорциональное интенсивности и длительности тренировок как у нетренированных, так и тренированных лиц (профессиональных спортсменов), мужчин и женщин разного возраста. По мере развития внутриклеточного дефицита L-карнитина снижается мышечная сила, переносимость физических нагрузок и развивается усталость. | + | В процессе физических нагрузок наблюдается снижение концентрации L-карнитина в плазме крови и мышечной ткани, пропорциональное интенсивности и длительности тренировок как у нетренированных, так и тренированных лиц (профессиональных спортсменов), мужчин и женщин разного возраста. По мере развития внутриклеточного дефицита L-карнитина снижается [[Сила мышц|мышечная сила]], переносимость физических нагрузок и развивается усталость. |
L-карнитин - условно незаменимая аминокислота, поступает в организм из трех источников: экзогенный путь (пища и добавки); эндогеный синтез в печени и почках; канальцевая реабсорбция в почках. Механизм действия связан с транспортом длинноцепочечных жирных кислот к матрице митохондрий для последующего бета-окисления, увеличением биосинтеза протеинов за счет сбережения использования аминокислот для продукции энергии, снижением катаболизма мышечных белков, усилением образования оксида азота. Таким образом, множественная направленность влияния L-карнитина на внутриклеточные процессы не позволяет однозначно трактовать метаболические эффекты этого соединения только с позиции усиления бета-окисления жирных кислот в митохондриях. | L-карнитин - условно незаменимая аминокислота, поступает в организм из трех источников: экзогенный путь (пища и добавки); эндогеный синтез в печени и почках; канальцевая реабсорбция в почках. Механизм действия связан с транспортом длинноцепочечных жирных кислот к матрице митохондрий для последующего бета-окисления, увеличением биосинтеза протеинов за счет сбережения использования аминокислот для продукции энергии, снижением катаболизма мышечных белков, усилением образования оксида азота. Таким образом, множественная направленность влияния L-карнитина на внутриклеточные процессы не позволяет однозначно трактовать метаболические эффекты этого соединения только с позиции усиления бета-окисления жирных кислот в митохондриях. | ||
| Строка 540: | Строка 110: | ||
Дополнительное экзогенное введение L-карнитина не показано начинающим спортсменам (не способствует ускорению роста тренированности во всех отношениях), а также при физических нагрузках низкой или средней величины. При таких условиях эндогенная биохимическая система адаптации в мышцах и других органах и тканях справляется самостоятельно с задачей обеспечения необходимого количества внутриклеточного карнитина. | Дополнительное экзогенное введение L-карнитина не показано начинающим спортсменам (не способствует ускорению роста тренированности во всех отношениях), а также при физических нагрузках низкой или средней величины. При таких условиях эндогенная биохимическая система адаптации в мышцах и других органах и тканях справляется самостоятельно с задачей обеспечения необходимого количества внутриклеточного карнитина. | ||
| − | L-карнитин и его аналоги при превентивном применении предупреждают развитие болезненности мышц (DOMS), возникающей после нагрузки как у тренированных, так и у нетренированых лиц. Одним из механизмов положительного влияния L-карнитина в отношении DOMS является расширение сосудов мышечной ткани за счет образования оксида азота с последующим повышением кровотока, улучшением энергетического метаболизма и снабжения мышц необходимыми нутриентами, снижение уровня гипоксии и торможения образования альгогенных метаболитов (кининов и простагландинов). Достаточно высокая степень доказанности эффективности применения L-карнитина в отношении профилактики DOMS и микроповреждений мышечных волокон (уровень доказательности «В») позволяет рекомендовать следующую схему: курсовой 2-3-недельный прием L-карнитина в дозе 2 г/день до начала нового цикла тренировок или после перерыва между регулярными тренировками. | + | L-карнитин и его аналоги при превентивном применении предупреждают развитие [[Боль в мышцах после тренировки|болезненности мышц]] (DOMS), возникающей после нагрузки как у тренированных, так и у нетренированых лиц. Одним из механизмов положительного влияния L-карнитина в отношении DOMS является расширение сосудов мышечной ткани за счет образования оксида азота с последующим повышением кровотока, улучшением энергетического метаболизма и снабжения мышц необходимыми нутриентами, снижение уровня гипоксии и торможения образования альгогенных метаболитов (кининов и простагландинов). Достаточно высокая степень доказанности эффективности применения L-карнитина в отношении профилактики DOMS и микроповреждений мышечных волокон (уровень доказательности «В») позволяет рекомендовать следующую схему: курсовой 2-3-недельный прием L-карнитина в дозе 2 г/день до начала нового цикла тренировок или после перерыва между регулярными тренировками. |
L-карнитин не повышает содержание карнитина в мышцах, не нормализует содержание жиров, и не улучшает аэробную и анаэробную физическую готовность у лиц с избыточным весом и ожирением. Карнитин оказывает минимальное (слабое) влияние на маркеры оксидативного стресса в процессе физических нагрузок у этой категории лиц, и не рекомендуется для включения в программы контроля веса (позиция Международного Общества Спортивного Питания – ISSN). | L-карнитин не повышает содержание карнитина в мышцах, не нормализует содержание жиров, и не улучшает аэробную и анаэробную физическую готовность у лиц с избыточным весом и ожирением. Карнитин оказывает минимальное (слабое) влияние на маркеры оксидативного стресса в процессе физических нагрузок у этой категории лиц, и не рекомендуется для включения в программы контроля веса (позиция Международного Общества Спортивного Питания – ISSN). | ||
| Строка 549: | Строка 119: | ||
== Читайте также == | == Читайте также == | ||
| − | |||
*[[L-карнитин: вред и побочные эффекты]] | *[[L-карнитин: вред и побочные эффекты]] | ||
| + | *[[L-карнитин для похудения]] | ||
| + | *[[L-карнитин отзывы]] | ||
| + | *[[L-карнитин и тренировки]] | ||
*[[Карнитин (медицинское применение)]] | *[[Карнитин (медицинское применение)]] | ||
| + | *[[Применение L-карнитина в спорте]] | ||
| + | *[[Эффекты L-карнитина]] | ||
| + | *[[BCAA: научный обзор]] | ||
*[[АТФ: научный обзор]] | *[[АТФ: научный обзор]] | ||
*[[Бета-аланин: научный обзор]] | *[[Бета-аланин: научный обзор]] | ||
| Строка 567: | Строка 142: | ||
== Ссылки == | == Ссылки == | ||
| − | + | <references/> | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
[[Категория:Спортивное_питание]] | [[Категория:Спортивное_питание]] | ||
Текущая версия на 14:06, 26 июня 2020
Содержание
- 1 L-карнитин и его производные в спортивной медицине
- 2 Введение
- 3 Химическая структура и фармакокинетика L-карнитина при приеме внутрь
- 4 Фармакодинамика (механизмы действия) L-карнитина
- 5 Дефицит карнитина в организме, изменение физических показателей и потенциальная роль мельдония в спорте
- 6 L-карнитин и функция мозга
- 7 Готовые формы БАДов с L-карнитином
- 8 Заключение
- 9 Читайте также
- 10 Ссылки
L-карнитин и его производные в спортивной медицине[править | править код]
Авторы: д.м.н. Александр Дмитриев, врач-эндокринолог Алексей Калинчев
Введение[править | править код]
Карнитин впервые был обнаружен в экстрактах мышечной ткани и выделен в 1905 году. Его химическая структура (3-гидрокси-4-N-триметил-аминомасляная кислота - 3- hydroxy-4-N-trimethyl-aminobutyric acid) установлена в 1927 году, а название «карнитин» дано от латинского слова «carno» (мясо). L-карнитин и его модификации – одни из наиболее часто применяемых пищевых добавок (БАДов) в спорте для улучшения физической формы и снижения отрицательного воздействия оксидативного стресса[1][2]. В то же время, доказательная база по целому ряду направлений (эргогенное действие при аэробных и анаэробных нагрузках, у нетренированных и тренированных атлетов, в программах снижения веса и коррекции состава тела и т.д.) весьма неоднородна и противоречива.
Отношение к пищевым добавкам L-карнитина в спортивной нутрициологии было сформулировано в 2010 году Международным Обществом Спортивного Питания (ISSN) в программной экспертной статье R.B.Kreider и соавторов[3]. Карнитин традиционно входил в группу веществ, используемых для контроля веса. Многочисленные исследования последних лет показали, что пищевые добавки L-карнитина не повышают содержание карнитина в мышцах, не нормализуют содержание жиров, и не улучшают аэробную и анаэробную физическую готовность у лиц с избыточным весом даже в сочетании с тренировочными программами. Карнитин оказывает умеренное влияние на маркеры оксидативного стресса в процессе физических нагрузок. Тем не менее, некоторые исследования показали, что карнитин может помочь в ситуации продолжительных интенсивных нагрузок у тренированных атлетов (профессионалов и любителей) при переходе на более высокий уровень спортивной формы. Эта же позиция подтверждена Американской Коллегией Спортивного Питания в 2013 году. За период 2014-2020 годов проведены исследования, которые несколько изменили эту позицию. Так, карнитин отдаляет момент наступления физической усталости и снижает накопление лактата в мышцах. В 2015 году показано, что при 2-х недельном приеме карнитина в дозе 2 г/сутки усиливаются антиоксидантные возможности организма до и после тренировок и снижаются показатели маркеров мышечных повреждений. Таким образом, если использовать карнитин не для контроля веса, а для повышения устойчивости к высоким физическим нагрузкам у тренированных спортсменов, то он проявляет активность. Ниже будут подробно рассмотрены отдельные физиологические свойства карнитина в организме спортсменов и лиц, ведущих активный образ жизни.
Химическая структура и фармакокинетика L-карнитина при приеме внутрь[править | править код]
Подробное изучение фармакокинетики L-карнитина при приеме внутрь проведено A.M.Evans и соавторами[4]. Как известно, у человека пул эндогенного карнитина, включающий свободный L-карнитин и линейку коротко-, средне- и длинноцепочечных эфиров, формируется и поддерживается абсорбцией L-карнитина из пищи (регулярная диета обеспечивает 2-12 мкмол/кг/день[5]), биосинтезом в организме из незаменимых аминокислот лизина и метионина (дает дополнительно 1,2 мкмол/кг/день L-карнитина) и экстенсивной канальцевой реабсорбцией этого вещества в почках. В указанных процессах имеет значение градиент концентраций ткани/плазма крови, которая критически зависит от окисления жирных кислот. Абсорбция L-карнитина после перорального приема происходит частично за счет трансмембранного транспорта (переноса) и, особенно, за счет пассивной диффузии. После приема внутрь дозы 1-6 г, абсолютная биодоступность составляет 5-18% соответственно дозе. В противоположность этому, биодоступность карнитина из пищи достигает 75%. Таким образом, фармакологические и пищевые добавки L-карнитина абсорбируются менее эффективно, чем соответствующие маленькие количества, представленные в обычной диете.
L-карнитин и его короткоцепочечные эфиры не связываются с белками плазмы крови и, хотя эритроциты содержат L-карнитин, его распределение между эритроцитами и плазмой происходит крайне медленно. После внутривенного введения начальный объем распределения составляет 0,2-0,3 л/кг, что соответствует объему внеклеточной жидкости. Существует по крайней мере три четких фармакокинетических компартмента для L-карнитина, причем пул карнитина в миокарде и скелетных мышцах является самым медленно балансирующимся. L-карнитин выводится из организма в основном через почки. В исходном состоянии почечный клиренс L-карнитина составляет 1-3 мл/мин, что меньше скорости гломерулярной фильтрации. Это доказывает наличие для этого вещества экстенсивной канальцевой реабсорбции (98-99%). Пороговая концентрация для тубулярной реабсорбции (на уровне которой фракционная реабсорбция начинает снижаться) составляет около 40-60 мкмол/л, что сходно с эндогенным уровнем L-карнитина в плазме. Поэтому почечный клиренс L-карнитина возрастает после его экзогенного введения, приближаясь по величине к скорости гломерулярной фильтрации после внутривенного введения в высоких дозах. Пациенты с первичным дефицитом карнитина (очень редкие состояния) имеют нарушения в обмене карнитина в почках и/или транспорте его в мышечную ткань. Сходным образом, при многих формах вторичного дефицита карнитина (примером является длительное, более 2-3 недель, применение мельдония – милдроната, или ХБП) возникает нарушение почечной тубулярной реабсорбции. Пациенты в конечной стадии ХБП, находящиеся на диализе, имеют вторичный дефицит L-карнитина из-за неограниченной потери карнитина через диализат, а сам карнитин в этой ситуации используется для лечения.
Как известно, в организме L-карнитин трансформируется в ацетил-L-карнитин и пропионил-L-карнитин. Кроме того, сами эти производные используются в качестве самостоятельных пищевых добавок. Поэтому в работе Y.Cao и соавторов[6] исследована фармакокинетика L-карнитина при однократном приеме внутрь в дозе 2 грамма (средняя стандартная доза) с отслеживанием изменений концентраций L-карнитина и двух его метаболитов (ацетил-L-карнитина и пропионил-L-карнитина) в плазме крови. 12 молодых здоровых участников (6 мужчин и 6 женщин, средний возраст 27,7 года, вес 62,9 кг, рост 167 см) принимали L-карнитин в разовой дозе 2 грамма в виде водного раствора. Пробы крови брались до приема карнитина, а также каждые 30 минут после приема (до 24 часов). Базовые концентрации L-карнитина и образующихся в организме в процессе метаболизма ацетил-L-карнитина и пропионил-L-карнитина в плазме крови приведены в таблице 1. Образцы мочи брались в следующие временные интервалы: 0~2 час, 2~4 час, 4~8 час, 8~12 час, 12~24 час.
Таблица 1. Исходные значения концентрации L-карнитина, ацетил-L-карнитина и пропионил-L-карнитина в плазме крови участников исследований фармакокинетики Y.Cao и соавторов (2009).
|
Концентрация вещества в плазме крови мкмол/л | |||
|
L-карнитин |
Ацетил-карнитин |
Пропионил-карнитин | |
|
Всего (n=12) |
39.1±5.4 |
2.4±0.б |
0.6±0.4 |
|
Мужчины (n=6) |
41.5±6.0 |
2.5±0.7 |
0.7±0.4 |
|
Женщины (п=6) |
36.8±4.0 |
2.2±0.5 |
0.6±0.4 |
Таблица 2. Основные фармакокинетические параметры после однократного приема L-карнитина в дозе 2 г. Y.Cao и соавт. (2009).
| L-карнитин | Ацетил-L-карнитин | Пропионил-L-карнитин | |
|---|---|---|---|
| Т1/2α (час) | 1.6±1.2 | -------- | -------- |
| Т1/2 (час) | 60.3±14.9 | 35.9±28.9 | 25.7±30.3 |
| V1/F(L) | 116.5±38.3 | 615.4±261.9 | 1163.5±1707.6 |
| CL/F(L·h-1) | 4.03±1.10 | 74.85±69.80 | 332.24±444.09 |
| AUC(0-t) (μmol·L-1·h) | 1354.4±325.0 | 119.5±55.8 | 57.9±48.5 |
| AUC(0-∞) (μmol·L-1·h) | 2676.4±708.3 | 166.2±77.4 | 155.6±264.2 |
| Ka(h-1) | 0.8±0.9 | 18.5±19.7 | 0.9±0.7 |
| t1/2Ka(h) | 1.0±0.8 | 0.6±0.6 | 1.2±0.9 |
| Tmax(h) | 3.4±0.5 | 2.4±0.7 | 3.8±0.8 |
| Cmax(μmol·L-1) | 84.7±25.2 | 12.9±5.5 | 5.1±3.1 |
Примечания: Т1/2α (час) – время распределения ½ введенного вещества; Т1/2 (час) – биологическое время полураспада; V1/F(л) – пероральный объем распределения в центральном компартменте; CL/F(л·час-1) – пероральный клиренс из центрального компартмента; AUC(0-t) (мкмол/л/час) – площадь под кривой «время-концентрация»; AUC(0-∞)(мкмол/л/час) - ; Ka – константа скорости абсорбции; Т1/2Ka(час) – полувремя абсорбции; Tmax(час) – время достижения максимальной концентрации; Cmax(мкмол/л) – максимальная концентрация.
Как видно из таблицы 1, между мужчинами и женщинами не отмечено различий в базовых концентрациях карнитина и его метаболитов. Из графиков на рисунках 2 и 3 также видно отсутствие гендерных различий в динамике концентраций карнитина, ацетил-карнитина и пропионил-карнитина в плазме крови после приема 2 г L-карнитина во время всего периода исследования. Корреляционный анализ выявил достоверную связь между изменениями концентраций L-карнитина и ацетил-L-карнитина, L-карнитина и пропионил-L-карнитина, а также ацетил-L-карнитина и пропионил-L-карнитина. 24-часовая аккумулированная экскреция L-карнитина с мочой (613,5±161,7 мкмол) была выше таковой для ацетил-L-карнитина (368,3±134,8 мкмол, P<0.01)) и пропионил-L-карнитина (61,3±37,8 мкмол, P<0.01) (рис.4). Скорость выведения L-карнитина с мочой составила в среднем 6,1% в течение 24 часов после приема внутрь. Анализируя полученные данные (таблица 2), авторы делают следующие выводы: 1) после приема 2 г L-карнитина доминирующим метаболитом в течение всего периода наблюдения остается сам L-карнитин, максимальная концентрация которого и площадь под кривой «концентрация-время» значительно выше, чем ацетил-L-карнитина и пропионил-L-карнитина ( примерно в 7 и 17 раз, соответственно; 2) отсутствуют гендерные различия в фармакокинетике L-карнитина и его метаболитов; 3) L-карнитин в плазме крови живет дольше, чем его метаболиты (примерно в 1,5-2,5 раза); 4) тонкий кишечник – основное место абсорбции L-карнитина, а сам процесс всасывания характеризуется медленным поступлением в слизистую кишечника, длительным накоплением в этих тканях и постепенным поступлением в кровяное русло (2-2,5 часа). После перорального приема пищевых добавок максимальная концентрация L-карнитина достигается через 3-4 часа; 5) имеется корреляция между изменениями концентрации всех трех аналогов карнитина в плазме крови, что свидетельствует о направленности метаболизма L-карнитина с образованием ацетил-L-карнитина и пропионил-L-карнитина уже в процессе всасывания в кишечнике. Как уже отмечалось выше, всасывание L-карнитина в виде пищевых добавок происходит медленнее и в меньших объемах, чем в составе пищи[7]. Кроме того, только 6,3% дозы L-карнитина, принятой внутрь, обнаруживается в моче в неизмененном виде, а 34% представлено метаболитами, преимущественно [3H]-триметиламин-N-оксидом. 22% выводятся с фекалиями, в основном в виде γ-бутиробетаина. Эти данные и выводы о фармакокинетике L-карнитина при однократном приеме в стандартной дозе 2 г/день полезны для установления режимов нутритивно-метаболической поддержки (НМП) спортсменов как с помощью самого L-карнитина, так и популярных пищевых добавок его производных – ацетил-L-карнитина и пропионил-L-карнитина.
Режим приема[править | править код]
Для планирования НМП с использованием аналогов L-карнитина важен режим приема в течение дня. В работе C. Herzmann и соавторов[8] показано, что однократный прием ацетил-L-карнитина в дозе 3 г/день и двукратный прием этого же вещества по 1,5 г 2 раза в день, дают одинаковый подъем концентрации метаболитов L-карнитина в плазме крови. Таким образом, не имеет принципиального значения, принимать ли L-карнитин однократно или два раза в день.
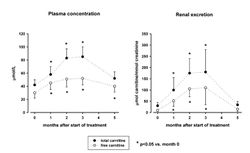
Еще одним важным аспектом фармакокинетики L-карнитина и его аналогов является определение режимов курсового применения, поскольку, как считает ряд экспертов, положительные эргогенные свойства L-карнитина проявляются не сразу (при однократном приеме), а постепенно (от 2-3 недель до 2-3 месяцев применения). В работе S. Wachter и соавторов[9] исследовано влияние ежедневного приема L-карнитина в дозе 2 г 2 раза в день в течение 3-х месяцев на концентрации L-карнитина в плазме крови и скелетных мышцах, а также состав тела и показатели физической готовности у молодых средней тренированности мужчин. В исследовании применялся велоэргометрический тест в течение 10 минут при 20%, 40% и 60% индивидуальной максимальной рабочей нагрузке (Pmax) до истощения. Как видно из рис.5, 3-х месячный прием L-карнитина приводил к достоверному удвоению концентраций как общего L-карнитина в плазме крови, так и свободного L-карнитина. Полное восстановление исходных концентраций L-карнитина происходило в течение 2-х месяцев после прекращения приема пищевой добавки. Динамика изменений почечной экскреции практически полностью повторяет динамику изменений L-карнитина в плазме крови. Однако, эти явные и достоверные фармакокинетические изменения в крови и моче не сопровождались значимыми изменениями ни физических показателей (VO2max, RERmax, и Pmax), ни увеличением концентрации L-карнитина в мышечной ткани или возрастанием активности митохондриальных ферментов цитрат синтазы и цитохромоксидазы и пролиферации митохондрий, ни изменениями состава мышечных волокон (по результатам биопсии мышц). Авторы делают заключение, что курсовое 3-х месячное применение L-карнитина в дозе 2 г 2 раза в день удваивает оборот L-карнитина в организме, но этот процесс не приводит к соответствующим сдвигам в биохимии и физиологии скелетных мышц, способствующим проявлениям эргогенного эффекта L-карнитина. Следовательно, эргогенное действие L-карнитина и его аналогов, проявляющееся при их курсовом приеме у определенной категории спортсменов высшей квалификации при интенсивных пролонгированных тренировках, не может быть объяснено только накоплением L-карнитина в скелетных мышцах и последующей активизацией митохондриальных процессов.
Фармакодинамика (механизмы действия) L-карнитина[править | править код]
В соответствии с имеющимися представлениями[10] L-карнитин – условно незаменимая аминокислота, - обнаруживается преимущественно в скелетных мышцах[11], и эндогенно синтезируется в печени и почках человека[12]. L-карнитин необходим для энергетического метаболизма жиров, белков и углеводов[11]. Главная его роль заключается в транспорте длинноцепочечных жирных кислот к матрице митохондрий для последующего бета-окисления[11]. Кроме того, L-карнитин увеличивает биосинтез протеинов за счет сбережения использования аминокислот для продукции энергии[13]. L-карнитин также подавляет гены, ответственные за деградацию протеинов в скелетной мускулатуре[14], и снижает конъюгаты мышечного RING-finger protein-1 (MuRF1 – новый ген миоцитов) и убиквитин-протеинa, участвующих в катаболизме белков, и увеличивает уровни IGF-1 и Akt1[15]. Таким образом, множественная направленность влияния L-карнитина на внутриклеточные процессы, выявленная в последние несколько лет, не позволяет однозначно трактовать метаболические эффекты этой аминокислоты только с позиции изменения жирового обмена и бета-окисления жирных кислот в митохондриях (см. в разделе «Фармакокинетика» отсутствие связи повышенного экзогенного поступления L-карнитина, изменения внутриклеточных концентраций L-карнитина и свойств мышечных волокон, и проявлений эргогенных свойств). Противоречивость клинических данных в спортивной нутрициологии о действии L-карнитина (наличие или отсутствие эргогенного эффекта в различных исследованиях) также может быть обусловлена попытками однозначной трактовки данных в связи с регулированием обмена липидов. Общая схема метаболизма L-карнитина представлена на рис.6[16].
Метаболизм L-карнитина исследован достаточно подробно (рис.6). Традиционно важная роль отводится бета-окислению жирных кислот с последующим увеличением доступности АТФ для выполнения механической работы[17]. Процесс бета-окисления состоит в последовательном укорочении цепочек жирных кислот с продукцией ацетил-CoA. Поскольку активированные длинноцепочечные жирные кислоты не способны проникать через внутреннюю митохондриальную мембрану, процесс укорочения их цепи обязательно предшествует их карнитин-зависимому транспорту в митохондриальное трансмембранное пространство. Процесс начинается с образования ацил-коэнзима А (acyl-CoA) с помощью ацил-коэнзим А-синтетазы (LCAS), которая локализуется в наружной митохондриальной мембране. Далее в процесс включаются потенциал-зависимые анионные каналы, через которые осуществляется активное движение жирных кислот. На этом этапе жирные кислоты подвергаются воздействию ацил-карнитина с ферментом CPT-I, который также находится на наружной митохондриальной мембране. Продукты этой реакции – эфиры карнитина, - транспортируются в митохондриальную матрицу посредством ряда биохимических реакций. Внутри матрицы эфиры ацил-карнитина трансформируются в соответствующие эфиры коэнзима А. Бета-окислительный процесс жирных кислот с очень длинной цепью происходит главным образом в пероксисомах, в то время как длинноцепочечные жирные кислоты окисляются и в пероксисомах и в митохондриях. Продукты окисления (включая промежуточные) окончательно метаболизируют до СО2 и воды. Пищевые добавки L-карнитина усиливают окисление жирных кислот в мышцах с получением АТФ, что может отсрочить использование гликогена мышечных клеток и, тем самым, отдалить начало развития усталости при физических нагрузках. В этом заключается гипотетический механизм эргогенного гликоген-сберегающего действия L-карнитина, который, как предполагается, переключает получение энергии из углеводного на жировой источник. Такой механизм может (опять же теоретически) увеличивать выносливость (отдалять наступление усталости).
Дефицит карнитина в организме, изменение физических показателей и потенциальная роль мельдония в спорте[править | править код]
Мельдоний и дефицит L-карнитина[править | править код]
- Основная статья: Мельдоний
N-триметил-гидразин-3-пропионат (N-trimethyl-hydrazine-3-propionate (THP или милдронат) – аналог карнитина, который используется в определенных странах в качестве кардиопротекторного препарата. В то же время, это вещество специально применяется в экспериментальных условиях для создания искусственного дефицита карнитина в организме (модель вторичного дефицита карнитина) за счет угнетения OCTN2 и g-бутиробетаин-гидроксилазы – последнего фермента в биосинтезе карнитина в клетках[18]. Хроническое применение THP у крыс в течение 2-3 недель снижает содержание карнитина в печени, сердце, плазме крови и скелетных мышцах на 70–80%[19]. Это снижение ассоциировано с развитием печеночного стеатоза[20], с нарушением функции миокарда[21], сократительной способности ряда скелетных мышц и их атрофией[22]. Однако, до настоящего времени не было ясно, связаны ли эти патологические органические изменения при хроническом приеме милдроната со снижением функциональной способности скелетной мускулатуры, как результата вторичного дефицита карнитина. Кроме того, было не ясно, повреждает ли дефицит карнитина функцию мышечных митохондрий и/или митохондриальный биогенез. Известно, что у спортсменов (особенно высокой квалификации) длительный прием L-карнитина улучшает показатели физической готовности и функцию митохондрий[23]. Для ответа на поставленные вопросы проведено франко-швейцарское экспериментальное исследование, результаты которого опубликованы в 2016 году J.Bouitbir и соавторами[24], посвященное оценке влияния вторичного дефицита карнитина, вызываемого хроническим приемом милдроната (ТНР), на способность переносить физические нагрузки и функцию митохондрий. Авторы пришли к заключению, что дефицит карнитина, вызываемый хроническим приемом милдроната (ТНР), сопровождается снижением толерантности к физическим нагрузкам в эксперименте. Механизмами падения мышечной функции под влиянием милдроната являются: нарушение транспорта электронов, снижение функции и атрофия митохондриальной ДНК скелетных мышц в условиях окислительного стресса. Таким образом, милдронат не только не может являться допингом в спорте, но и потенциально противопоказан активно тренирующимся лицам. Включение мельдония в список запрещенных субстанций WADA является типичной ошибкой, основанной на широком применении этого вещества атлетами ряда стран с целью улучшения восстановления после интенсивных тренировок. Те немногочисленные работы в спортивной нутрициологии с применением мельдония (милдроната), выполнены много лет назад на малой выборке, без соблюдения необходимых условий исследования пищевых добавок, и с точки зрения доказательной медицины относятся к категории «D» (самый низкий уровень). Несмотря на десятилетия использования мельдония в спорте, не было предпринято никаких усилий по комплексной оценке его эргогенных, восстановительных и иных эффектов. Однако, постоянное присутствие мельдония в крови отдельных спортсменов и целых команд, вызвало обоснованные подозрения антидопинговых структур. Это привело к созданию методик определения вещества в организме и последующему включению в список запрещенных субстанций[25], несмотря на отсутствие доказательств стимуляции физических кондиций атлетов.
L-карнитин и функция мозга[править | править код]
Единственной формой L-карнитина, способной проникать через гемато-энцефалический барьер (ГЭБ) является ацетил L-карнитин (ALC). Поэтому при создании продуктов, имеющих конечной целью улучшение деятельности ЦНС, используется ацетил-L-карнитин, или, для воздействие сразу на несколько звеньев регуляции гомеостаза, – комбинация ацетил L-карнитина с другими формами. Роль ацетил L-карнитина в мозге заключается в улучшении когнитивных функций. Давно известно сходство его структуры с нейромедиатором ацетилхолином и способность стимулировать рецепторы последнего[26]. Подробный анализ транспорта и роли ALC в мозге дан в обзоре K.A.Nałezcz и соавторов[27]. ALC как фармаконутриент применяется при лечении хронических нейродегенеративных заболеваний, в частности болезни Альцгеймера. Кроме ALC, проникающего из крови через ГЭБ, имеется внутримозговой синтез ALC[28]. Снижение содержания ALC в мозге ухудшает когнитивные функции и требует прямой или непрямой коррекции дефицита. Однако, на сегодняшний день практически нет данных о влиянии L-карнитина на функции мозга при физических нагрузках. А одних теоретических обоснований с точки зрения доказательных принципов спортивной нутрициологии недостаточно для создания рекомендаций.
Готовые формы БАДов с L-карнитином[править | править код]
В распоряжении спортивных нутрициологов имеется достаточно большое число различных форм L-карнитина и его комбинаций с другими нутриентами: L-карнитин (основная форма), ацетил-L-карнитин, пропионил L-карнитин, глицин пропионил-L-карнитин, L-карнитина тартрат, L-карнитина фумарат. L-карнитин наиболее удобен для жидких вариантов БАДов, но в составе капсул и таблеток он может впитывать влагу из воздуха и приводить к порче продукта. Крупные производители развивают более стабильные формулы, наиболее подходящие для таблеток и капсул – L-карнитина тартрат и фумарат. Новой интересной патентованной формулой является ацетил L-карнитин аргината дигидрохлорид (acetyl-L-carnitine arginate dihydrochloride) с молекулярно связанной аминокислотой аргинином (коммерческое наименование АргиноКарн (ArginoCarn®). С точки зрения развития эргогенных свойств и непрямой донации оксида азота наиболее перспективной считается пока недостаточно изученная формула глицин пропионил-L-карнитина гидрохлорид. На сочетании нескольких формул строится структура коммерческих продуктов L-карнитина у многих ведущих компаний.
Заключение[править | править код]
В процессе физических нагрузок наблюдается снижение концентрации L-карнитина в плазме крови и мышечной ткани, пропорциональное интенсивности и длительности тренировок как у нетренированных, так и тренированных лиц (профессиональных спортсменов), мужчин и женщин разного возраста. По мере развития внутриклеточного дефицита L-карнитина снижается мышечная сила, переносимость физических нагрузок и развивается усталость.
L-карнитин - условно незаменимая аминокислота, поступает в организм из трех источников: экзогенный путь (пища и добавки); эндогеный синтез в печени и почках; канальцевая реабсорбция в почках. Механизм действия связан с транспортом длинноцепочечных жирных кислот к матрице митохондрий для последующего бета-окисления, увеличением биосинтеза протеинов за счет сбережения использования аминокислот для продукции энергии, снижением катаболизма мышечных белков, усилением образования оксида азота. Таким образом, множественная направленность влияния L-карнитина на внутриклеточные процессы не позволяет однозначно трактовать метаболические эффекты этого соединения только с позиции усиления бета-окисления жирных кислот в митохондриях.
Увеличение мышечной силы и мощности как компонент эргогенного действия пищевых добавок L-карнитина и его аналогов проявляется преимущественно при высокой физической нагрузке (по продолжительности и величине) у хорошо тренированных лиц при переходе на более высокий уровень физической готовности. При этом даже небольшое повышение уровня внутримышечного карнитина требует длительного приема пищевых его добавок (курсовое назначение в дозах 2-3 г/день продолжительностью от 2-3 недель). В количественном плане этот компонент выражен умеренно и не является доминирующим.
Другой компонент эргогенного действия L-карнитина – повышение выносливости, - проявляется как при однократном, так и курсовом (от 3-х недель) приеме вещества в дозах равных или превышающих 3-4 грамма в сутки, у спортсменов или активно тренирующихся лиц средней и высокой квалификации, сопровождается повышением уровней оксида азота, лактатного порога и уменьшением динамики накопления лактата в плазме крови. Эффективность L-карнитина в отношении выносливости у определенных групп спортсменов возрастает при совместном приеме с углеводами и L-глутамином или его дипептидами.
Дополнительное экзогенное введение L-карнитина не показано начинающим спортсменам (не способствует ускорению роста тренированности во всех отношениях), а также при физических нагрузках низкой или средней величины. При таких условиях эндогенная биохимическая система адаптации в мышцах и других органах и тканях справляется самостоятельно с задачей обеспечения необходимого количества внутриклеточного карнитина.
L-карнитин и его аналоги при превентивном применении предупреждают развитие болезненности мышц (DOMS), возникающей после нагрузки как у тренированных, так и у нетренированых лиц. Одним из механизмов положительного влияния L-карнитина в отношении DOMS является расширение сосудов мышечной ткани за счет образования оксида азота с последующим повышением кровотока, улучшением энергетического метаболизма и снабжения мышц необходимыми нутриентами, снижение уровня гипоксии и торможения образования альгогенных метаболитов (кининов и простагландинов). Достаточно высокая степень доказанности эффективности применения L-карнитина в отношении профилактики DOMS и микроповреждений мышечных волокон (уровень доказательности «В») позволяет рекомендовать следующую схему: курсовой 2-3-недельный прием L-карнитина в дозе 2 г/день до начала нового цикла тренировок или после перерыва между регулярными тренировками.
L-карнитин не повышает содержание карнитина в мышцах, не нормализует содержание жиров, и не улучшает аэробную и анаэробную физическую готовность у лиц с избыточным весом и ожирением. Карнитин оказывает минимальное (слабое) влияние на маркеры оксидативного стресса в процессе физических нагрузок у этой категории лиц, и не рекомендуется для включения в программы контроля веса (позиция Международного Общества Спортивного Питания – ISSN).
L-карнитин и его аналоги являются веществами с очень широким диапазоном безопасности и рекомендованы в качестве пищевых добавок и компонентов функциональной пищи в большинстве стран. Современные формы L-карнитина для этих целей включают: L-карнитин (основная форма); ацетил-L-карнитин; пропионил L-карнитин; глицин пропионил-L-карнитин; L-карнитина тартрат; L-карнитина фумарат; ацетил L-карнитин аргината дигидрохлорид; глицин пропионил-L-карнитина гидрохлорид.
Читайте также[править | править код]
- L-карнитин: вред и побочные эффекты
- L-карнитин для похудения
- L-карнитин отзывы
- L-карнитин и тренировки
- Карнитин (медицинское применение)
- Применение L-карнитина в спорте
- Эффекты L-карнитина
- BCAA: научный обзор
- АТФ: научный обзор
- Бета-аланин: научный обзор
- Глутамин: научный обзор
- HMB: научный обзор
- Донаторы оксида азота: научный подход
- Креатин: научный обзор
- Нейростимуляторы и нейропротекторы в спортивном питании: научный обзор
- Омега-3 жирные кислоты: научный обзор
- Омега-5 жирные кислоты: научный обзор
- Омега-7 жирные кислоты: научный обзор
- Спортивные напитки: научный обзор
- Препараты витамина D в спортивной медицине: научный обзор
Ссылки[править | править код]
- ↑ Miklos A., Ciulea L., Vari C.E. et al. The efficiency and safety of L-carnitine and caffeine after short- and long-term administration. Palestrica of the third millennium – Civilization and Sport, 2016, 17(3): 229–232.
- ↑ Sung D.J., Kim S., Kim J. et al. Role of l-carnitine in sports performance: Focus on ergogenic aid and antioxidant. Sci and Sports, 2016, [Epub ahead of print]. doi:10.1016/j.
- ↑ Kreider R.B., Wilborn C.D., Taylor L. et al. ISSN exercise and sport nutrition review: research and recommendations. J.Intern.Soc.Sports Nutr., 2010, 7:7-50.
- ↑ Evans A.M., Fornasini G. Pharmacokinetics of L-carnitine. Clin.Pharmacokinet., 2003, 42(11):941-967.
- ↑ El-Hattab A.W., Scaglia F. Disorders of carnitine biosynthesis and transport. Mol.Genet.Metab., 2015, 116(3):107-112.
- ↑ Cao Y., Wang Y-X., Liu Ch-J. Comparison of pharmacokinetics of L-carnitine, AcetylL-carnitine and Propionyl-Lcarnitine after single oral administration of L-carnitine in healthy volunteers. Clin.Invest.Med., 2009; 32 (1): E13-E19.
- ↑ Rebouche C.J. Quantitative estimation of absorption and degradation of a carnitine supplement by human adults. Metabolism, 1991, 40:1305-1310.
- ↑ Herzmann C., Whiting S.J., Thomas M. Pharmacokinetics of Acetyl-L-Carnitine Given in Single or Multiple Doses to HIV-1 Infected Patients with Toxic Peripheral Polyneuropathy. The Open AIDS J., 2008, 2: 39-42.
- ↑ Wachter S., Vogt M., Kreis R. et al. Long-term administration of L-carnitine to humans: effect on skeletal muscle carnitine content and physical performance. Clinica Chimica Acta, 2002, 318: 51 – 61.
- ↑ Evans А.M., Guthrie N., Pezzullo J. Efficacy of a novel formulation of L-Carnitine, creatine, and leucine on lean body mass and functional muscle strength in healthy older adults: a randomized, double-blind placebo-controlled study. Nutrition and Metabolism, 2017, 14:7-22.
- ↑ 11,0 11,1 11,2 Reuter S.E., Evans A.M. Carnitine and acylcarnitines: pharmacokinetic, pharmacological and clinical aspects. Clin.Pharmacokinet., 2012, 51(9):553–572.
- ↑ Steiber A., Kerner J., Hoppel C.L. Carnitine: a nutritional, biosynthetic, and functional perspective. Mol.Aspects Med., 2004, 25(5–6):455–473.
- ↑ Owen K.Q., Jit H., Maxwell C.V. et al. Dietary L-carnitine suppresses mitochondrial branched chain ketoacid dehydrogenase activity and enhances protein accretion and carcass characteristics of swine. J.Anim.Sci., 2001, 79(12):3104–3112.
- ↑ Keller J., Ringseis R., Koc A. et al. Supplementation with l-carnitine downregulates genes of the ubiquitin proteasome system in the skeletal muscle and liver of piglets. Animal., 2012, 6(1):70–78.
- ↑ Keller J., Couturier A., Haferkamp M. et al. Supplementation of carnitine leads to an activation of the IGF-1/PI3K/Akt signalling pathway and down regulates the E3 ligase MuRF1 in skeletal muscle of rats. Nutr.Metab.(Lond). 2013, 10(1):28.
- ↑ Балыкова Л.А., Ивянский С.А., Пиксайкина О.А., Ефимова Ю.А. Обоснование использования L-карнитина в спортивной медицине. Спортивная медицина: наука и практика. 2011, 1:22-30.
- ↑ Gorostiaga E.M., Maurer C.A., Eclache J.P. Decrease in respiratory quotient during exercise following L-carnitine supplementation. Int.J.Sports Med., 1989, 10:169.
- ↑ Vaz F.M., Wanders R.J. Carnitine biosynthesis in mammals. Biochem.J., 2002, 361,417–429.
- ↑ Spaniol M., Brooks H., Auer L. et al. Development and characterization of ananimal model of carnitine deficiency. Eur.J.Biochem, 2001, 268,1876–1887.
- ↑ Spaniol M., Kaufmann P., Beier K. et al. Mechanisms of liver steatosis in rats with systemic carnitine deficiency due to treatment with trimethylhydraziniumpropionate. J.Lipid.Res., 2003, 44, 144–153.
- ↑ Zaugg C.E., Spaniol M., Kaufmann P. et al. Myocardial function and energy metabolism in carnitine-deficient rats. Cell.Mol.Life Sci., 2003, 60,767–775.
- ↑ Roberts P. A., Bouitbir J., Bonifacio A. et al. Contractile function and energy metabolism of skeletal muscle in rats with secondary carnitine deficiency. Am.J.Physiol.Endocrinol.Metab., 309, E265–E274.
- ↑ Huertas R., Campos Y., Díaz E. et al. Respiratory chain enzymes in muscle of endurance athletes: effectof L-carnitine. Biochem.Biophys.Res.Commun., 1992, 188,102–107.
- ↑ Bouitbir J., Haegler P., Singh F. Impaired Exercise Performance and Skeletal Muscle Mitochondrial Functionin Rats with Secondary Carnitine Deficiency. Frontiers in Physiology, 2016, 7(345): 1-13.
- ↑ World antidoping code international standard, Prohibited List, 2017.
- ↑ Falchetto S., Kato G., Provini L. The action of carnitines on cortical neurons. Can.J.Physiol.Pharmacol., 1971, 49: 1–7.
- ↑ Nałezcz K.A., Miecz D., Berezowski V., Cecchelli R. Carnitine: transport and physiological functions in the brain. Molecular Aspects of Medicine, 2004, 25:551–567.
- ↑ Wawrzenczyk A., Nałezcz K.A., Nałezcz M.J. Effect of externally added carnitine on the synthesis of acetylcholine in rat cerebral cortex cells. Neurochem.Int., 1995, 26: 635–641.