Гипераммониемия при физических нагрузках — различия между версиями
Krash (обсуждение | вклад) (→Читайте также) |
Krash (обсуждение | вклад) |
||
| Строка 2: | Строка 2: | ||
=== Накопление продуктов азотистого обмена в процессе интенсивных и продолжительных тренировок === | === Накопление продуктов азотистого обмена в процессе интенсивных и продолжительных тренировок === | ||
| − | + | [[Image:Keto_Ris_1.jpg|250px|thumb|right|Рис.1. Метаболизм незаменимых аминокислот с разветвленной цепью (ВСАА: лейцин, изолейцин и валин) в митохондриях клеток скелетных мышц. ВСКDH – ферментный комплекс, ограничивающий данное направление. ВСАА обеспечивает дополнительную энергию через цикл трикарбоновых кислот (ТСА), но в то же время, является дополнительным источником образования «отходов» - аммиака. AАТ – аланин-аминотрнасфераза (контролирует конверсию пирувата в аланин); ВСАТ – аминотрансфераза ВСАА; ВСКА – кето-форма ВСАА (без аминогруппы); СоА-SH – редуцированная форма коэнзима А; GDH – глутамат-дегидрогеназа (контролирует конверсию глутамата до аммиака). Из D.J.Wilkinson и соавт. (2010).]] | |
Проблема нарастающего накопления продуктов [[Азотистый баланс|азотистого обмена]] (ПАО) в крови, мозге и мышцах в процессе больших физических нагрузок является предметом пристального внимания еще с начала 1960-х годов. Аккумуляция аммиака рассматривается в качестве одной из существенных причин [[Мышечная усталость и митохондриальное дыхание|усталости]] нейрогенного происхождения в спорте<ref name="Lowenstein">Lowenstein J.M. Ammonia production in muscle and other tissues: the purine nucleotide cycle. Physiol.Rev., 1972, 52:382-414.</ref><ref name="Much">Much B.J.C., Banister E.W. Ammonia metabolism in exercise and fatigue; a review. Med.Sci.Sports Exerc., 1983, 15(1):41-50.</ref><ref name="Brouns">Brouns F., Beckers E., Wagenmakers A.J.M., Saris W.H.M. Ammonia accumulation during highly intensive long-lasting cycling: individual observations. Int.J.Sports Med., 1990, 11(Suppl.2): S78-S84.</ref>. Эти биохимические изменения сочетаются с такими факторами развития [[Утомление мышц|утомления]] как накопление [[лактат]]а, снижение [[PH крови: кислотно-щелочное равновесие|рН]] и дисбаланс электролитов. Согласно «аммониевой теории развития усталости»<ref name="Wilkinson">Wilkinson D.J., Smeeton N.J., Watt P.W. Ammonia metabolism, the brain and fatigue; revisiting the link. Prog.Neurobiol., 2010, 91(3):200-219.</ref>, избыточный аммиак, образующийся в организме в процессе жизнедеятельности, должен максимально быстро быть удален, поскольку является естественным «отходом» обмена веществ. Усталость – синоним широкого спектра хорошо известных физиологических проявлений в спорте высших достижений и обычного [[Высокоинтенсивный интервальный тренинг (ВИТ)|высокоинтенсивного тренировочного процесса]], в основе которых лежат следующие механизмы<ref name="Wilkinson" />: | Проблема нарастающего накопления продуктов [[Азотистый баланс|азотистого обмена]] (ПАО) в крови, мозге и мышцах в процессе больших физических нагрузок является предметом пристального внимания еще с начала 1960-х годов. Аккумуляция аммиака рассматривается в качестве одной из существенных причин [[Мышечная усталость и митохондриальное дыхание|усталости]] нейрогенного происхождения в спорте<ref name="Lowenstein">Lowenstein J.M. Ammonia production in muscle and other tissues: the purine nucleotide cycle. Physiol.Rev., 1972, 52:382-414.</ref><ref name="Much">Much B.J.C., Banister E.W. Ammonia metabolism in exercise and fatigue; a review. Med.Sci.Sports Exerc., 1983, 15(1):41-50.</ref><ref name="Brouns">Brouns F., Beckers E., Wagenmakers A.J.M., Saris W.H.M. Ammonia accumulation during highly intensive long-lasting cycling: individual observations. Int.J.Sports Med., 1990, 11(Suppl.2): S78-S84.</ref>. Эти биохимические изменения сочетаются с такими факторами развития [[Утомление мышц|утомления]] как накопление [[лактат]]а, снижение [[PH крови: кислотно-щелочное равновесие|рН]] и дисбаланс электролитов. Согласно «аммониевой теории развития усталости»<ref name="Wilkinson">Wilkinson D.J., Smeeton N.J., Watt P.W. Ammonia metabolism, the brain and fatigue; revisiting the link. Prog.Neurobiol., 2010, 91(3):200-219.</ref>, избыточный аммиак, образующийся в организме в процессе жизнедеятельности, должен максимально быстро быть удален, поскольку является естественным «отходом» обмена веществ. Усталость – синоним широкого спектра хорошо известных физиологических проявлений в спорте высших достижений и обычного [[Высокоинтенсивный интервальный тренинг (ВИТ)|высокоинтенсивного тренировочного процесса]], в основе которых лежат следующие механизмы<ref name="Wilkinson" />: | ||
*Накопление периферических токсинов/метаболических субпродуктов; | *Накопление периферических токсинов/метаболических субпродуктов; | ||
| Строка 13: | Строка 13: | ||
=== Роль ВСАА в накоплении продуктов азотистого обмена в процессе интенсивных и продолжительных тренировок === | === Роль ВСАА в накоплении продуктов азотистого обмена в процессе интенсивных и продолжительных тренировок === | ||
| − | + | ||
Давно известно, что [[BCAA]] в процессе продолжительных тренировок может обеспечивать до 10% общей расходуемой спортсменом энергии<ref>Brookes G.A. Amino acid and protein metabolism during exercise and recovery. Med.Sci.Sports Exercise, 1987, 19, S150–S156.</ref>. [[Аминокислоты с разветвленными боковыми цепями|Длинно-цепочечные незаменимые аминокислоты с разветвленной цепью]] – ВСАА – [[лейцин]], [[изолейцин]] и [[валин]], - составляют примерно 40% [[Незаменимые аминокислоты|незаменимых аминокислот]] (ЕАА), поступающих с пищей, и играют важную роль в структуре глобулярных и мембранных протеинов, особенно в мышечной ткани<ref>Brosnan J.T., Brosnan M.E. Branched-chain amino acids: enzyme and substrate regulation. J. Nutr., 2006, 136, 207S–211.</ref>(см. обзор «[[BCAA: научный обзор|BCAA в спортивной медицине]]»). В митохондриях [[Скелетные мышцы|скелетных мышц]] ВСАА подвергаются метаболическим изменениям за счет двух ферментов (рис.1): 1) аминотрансферазы АК с разветвленной цепью (ВСАТ) и 2) дегидрогеназы альфа-кето-АК с разветвленной цепью (ВСКDH). В результате образуются соединения с коэнзимом А, которые могут утилизироваться в цикле трикарбоновых кислот (ТСА) для получения энергии в процессе окисления<ref>Shimomura Y., Honda T., Shiraki M. et al. Branched-chain amino acid catabolism in exercise and liver disease. J.Nutr., 2006, 136: 250S–253.</ref><ref>Shimomura Y., Murakami T., Nakai N. et al. Exercise promotes BCAA catabolism: effects of BCAA supplementation on skeletal muscle during exercise. J.Nutr., 2004, 134: 1583S–1587S.</ref>. | Давно известно, что [[BCAA]] в процессе продолжительных тренировок может обеспечивать до 10% общей расходуемой спортсменом энергии<ref>Brookes G.A. Amino acid and protein metabolism during exercise and recovery. Med.Sci.Sports Exercise, 1987, 19, S150–S156.</ref>. [[Аминокислоты с разветвленными боковыми цепями|Длинно-цепочечные незаменимые аминокислоты с разветвленной цепью]] – ВСАА – [[лейцин]], [[изолейцин]] и [[валин]], - составляют примерно 40% [[Незаменимые аминокислоты|незаменимых аминокислот]] (ЕАА), поступающих с пищей, и играют важную роль в структуре глобулярных и мембранных протеинов, особенно в мышечной ткани<ref>Brosnan J.T., Brosnan M.E. Branched-chain amino acids: enzyme and substrate regulation. J. Nutr., 2006, 136, 207S–211.</ref>(см. обзор «[[BCAA: научный обзор|BCAA в спортивной медицине]]»). В митохондриях [[Скелетные мышцы|скелетных мышц]] ВСАА подвергаются метаболическим изменениям за счет двух ферментов (рис.1): 1) аминотрансферазы АК с разветвленной цепью (ВСАТ) и 2) дегидрогеназы альфа-кето-АК с разветвленной цепью (ВСКDH). В результате образуются соединения с коэнзимом А, которые могут утилизироваться в цикле трикарбоновых кислот (ТСА) для получения энергии в процессе окисления<ref>Shimomura Y., Honda T., Shiraki M. et al. Branched-chain amino acid catabolism in exercise and liver disease. J.Nutr., 2006, 136: 250S–253.</ref><ref>Shimomura Y., Murakami T., Nakai N. et al. Exercise promotes BCAA catabolism: effects of BCAA supplementation on skeletal muscle during exercise. J.Nutr., 2004, 134: 1583S–1587S.</ref>. | ||
Версия 12:35, 30 июня 2020
Гипераммониемия при физических нагрузках
Накопление продуктов азотистого обмена в процессе интенсивных и продолжительных тренировок
Проблема нарастающего накопления продуктов азотистого обмена (ПАО) в крови, мозге и мышцах в процессе больших физических нагрузок является предметом пристального внимания еще с начала 1960-х годов. Аккумуляция аммиака рассматривается в качестве одной из существенных причин усталости нейрогенного происхождения в спорте[1][2][3]. Эти биохимические изменения сочетаются с такими факторами развития утомления как накопление лактата, снижение рН и дисбаланс электролитов. Согласно «аммониевой теории развития усталости»[4], избыточный аммиак, образующийся в организме в процессе жизнедеятельности, должен максимально быстро быть удален, поскольку является естественным «отходом» обмена веществ. Усталость – синоним широкого спектра хорошо известных физиологических проявлений в спорте высших достижений и обычного высокоинтенсивного тренировочного процесса, в основе которых лежат следующие механизмы[4]:
- Накопление периферических токсинов/метаболических субпродуктов;
- Центральная (нейрогенная) саморегуляция – адаптивная защитная реакция;
- Продукция воспалительных цитокинов;
- Нарушение нейромедиаторных механизмов;
- Периферический регуляторный контроль управления метаболизмом органов и тканей.
Идея о том, что накопление аммиака играет значительную роль в развитии усталости, далеко не нова, и берет свое начало с 20-х годов прошлого столетия – установления факта образования аммиака из аденозинмонофосфата (АМФ) в мышцах при интенсивной стимуляции мышечных сокращений[5]. Последующие работы выявили очень важную в теоретическом и практическом плане зависимость уровня накопления аммиака в плазме крови от интенсивности физической нагрузки: минимальные изменения концентрации при интенсивности ниже 50-60% VO2, но быстрое нарастание концентраций при увеличении нагрузок, особенно, на уровне истощения[6][7]. Однако, не только интенсивность, но и продолжительность физической нагрузки определяет нарастание концентрации аммиака. Продолжительные (более 1 часа) субмаксимальные тренировки (60–75% VO2max) способствуют накоплению аммиака за счет разрушения ВСАА в мышцах для получения дополнительной энергии[8][9]. Серия исследований лаборатории E.W.Banister и его сотрудников[2][10][11] доказала прямую зависимость физической нагрузки, развития усталости и накопления азотистых продуктов метаболизма на периферии и в ЦНС. Высокие концентрации аммиака повышают скорость наступления усталости, риск развития мышечных судорог, снижают сократительную способность скелетных мышц, замедляют восстановление после нагрузки.
Роль ВСАА в накоплении продуктов азотистого обмена в процессе интенсивных и продолжительных тренировок
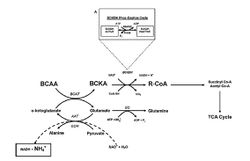
Давно известно, что BCAA в процессе продолжительных тренировок может обеспечивать до 10% общей расходуемой спортсменом энергии[12]. Длинно-цепочечные незаменимые аминокислоты с разветвленной цепью – ВСАА – лейцин, изолейцин и валин, - составляют примерно 40% незаменимых аминокислот (ЕАА), поступающих с пищей, и играют важную роль в структуре глобулярных и мембранных протеинов, особенно в мышечной ткани[13](см. обзор «BCAA в спортивной медицине»). В митохондриях скелетных мышц ВСАА подвергаются метаболическим изменениям за счет двух ферментов (рис.1): 1) аминотрансферазы АК с разветвленной цепью (ВСАТ) и 2) дегидрогеназы альфа-кето-АК с разветвленной цепью (ВСКDH). В результате образуются соединения с коэнзимом А, которые могут утилизироваться в цикле трикарбоновых кислот (ТСА) для получения энергии в процессе окисления[14][15].
Под влиянием ВСАТ от ВСАА отщепляется аминогруппа, которая взаимодействует с 2-оксоглутаратом, образуя глутамат, а ВСАА превращаются в кето-форму (ВСКА), лишенную азота. Все эти реакции до определенного этапа сопровождаются минимальным образованием аммиака (минимальное деаминирование ВСАА), который является естественным метаболитом – участником нормальных биохимических реакций в тренировочном и соревновательном процессе. Но, с нарастанием интенсивности мышечных движений и их продолжительности, биохимические реакции сдвигаются в сторону избыточного образования аммиака.
Патогенетические механизмы гипераммониемии заключаются в следующем:
- Ткань мозга, лишенная (в отличие от печени) биохимического цикла утилизации мочевины, получает аммиак из циркулирующей крови после его прохождения через ГЭБ;
- Первичным звеном взаимодействия с аммиаком в мозгу являются астроциты, которые защищают нейроны и выполняют вспомогательную функцию в передаче нервных импульсов и метаболизме нейронов;
- Обычные концентрации аммиака играют положительную метаболическую роль в мозгу, обеспечивая функционирование, в частности, ГАМК-ергической системы;
- Превышение определенных концентраций аммиака в мозгу ведет к нарушению функции астроцитов и нейронов;
- В условиях повышенных пролонгированных физических нагрузок установлена положительная корреляция между возрастанием концентрации аммиака в крови и в мозге[16];
- Повышенная концентрация аммиака в астроцитах ведет к их отеку, функциональным и морфологическим изменениям. Нарушается функция митохондрий и их чувствительность к реактивным окислительным субстанциям;
- Снижается межнейрональная передача;
- Нарушаются процессы обучения и памяти (гипераммониемия нарушает функционирование соответствующих структур мозга), фокусировка внимания, снижается реакция на большинство видов стимуляции;
- Ослабляется регулирование моторных функций (нарушение глутаматергической передачи).
Аммониевый порог (ammonia threshold) – уровень физической нагрузки (определяемый, как правило, в лабораторных условиях), при котором в плазме крови появляется аммоний с последующим градуальным нарастанием его концентраций в соответствии с возрастающей нагрузкой. Примером определения аммониевого порога (АТ) может служить типичное исследование C.Yges и соавторов[17] с участием 26 тренированных спортсменов, выполняющих тесты на беговой дорожке субмаксимальной и максимальной интенсивности, а также «полевой» тест, который включал три различных скоростных режима. В процессе субмаксимального теста АТ был определен у 23 (88,5%) испытуемых по анализу образцов крови из пальца, который показывал содержание аммиака и лактата. Важным результатом было совпадение аммониевого и лактатного порогов у большинства испытуемых, которые в целом коррелируют между собой. Однако при увеличении продолжительности и интенсивности нагрузок, содержание аммиака в крови прогрессивно нарастало, в то время как уровень лактата оставался достаточно стабильным (не менее 4 ммол/л). Целый ряд аналогичных работ показал, что АТ является адекватным показателем уровней физической нагрузки при тренировках высокой интенсивности и продолжительности, и должен использоваться в практической деятельности спортивных врачей и тренеров, наряду с оценкой накопления лактата.
Клинические исследования гипераммониемии у спортсменов высшей квалификации
В работе W.S.Coelho и соавторов[18] исследовался метаболический ответ у элитных каноистов (участников мировых чемпионатов, Олимпийских и Панамериканских Игр) в ходе комбинированной тренировочной сессии. В ходе исследования спортсмены поддерживали обычный режим гидратации и потребления пищи. Для оценки физического статуса фиксировались антропометрические данные и лабораторные данные биохимии и клеточного состава крови. Тренировочный протокол (рис.2) состоял из нескольких спринтерских заездов на различных дистанциях и интенсивностях с трехминутными интервалами между ними. Общая протяженности дистанции – 16 км (на рис.2 – от Т1 до Т2). Эта часть протокола продолжалась 210 мин с последующим 20-минутным отдыхом (Т2-Т3), во время которого участники выпивали 500 мл напитка (20% углеводов, 2% липидов, 5% протеинов (whey-протеин+казеин). С 230 минуты по 280 минуту проводилась силовая тренировка (подъем тяжестей) для больших верхних и нижних мышечных групп, затем – 70-минутный отдых. В процессе исследования установлено: значительное повышение аспартат аминотрансферазы (AST, на 30% в ходе тренировки, и до 40% после нее), миоглобина (на 170%), показателей мышечных повреждений (на 160-170%), лейкоцитов (42-60%) за счет преимущественно, нейтрофилов (до 166%), тромбоцитов (на 30%). Чрезвычайно показательным было изменение концентрации в плазме крови ВСАА (рис.3).

Как видно из рис.3, концентрации ВСАА – важнейшего «топливного» и метаболического (для синтеза протеинов) субстрата, снижаются сразу же под воздействием обоих видов физической нагрузки. Особенно заметным было снижение лейцина (до 50%) во время гребного спринта, а также во время силовых тренировок (до 22%). Выявленное снижение продолжалось и в период отдыха. Содержание ароматических АК прогрессивно снижалось на 15-20% во время нагрузки, с тенденцией быстрого восстановления во время отдыха. Очень динамичным и показательным было изменение уровня аммиака в процессе тренировочного цикла (рис.4, график А).

Отчетливо видно нарастание концентрации аммиака в крови по мере прохождения дистанции (до 80% к концу серии спринтов) и завершения силовых упражнений (до 70% к концу нагрузочного периода). Эти изменения носили гораздо более динамичный характер по сравнению с изменениями концентрации других нитрогенных веществ (мочевины, мочевой кислоты, креатинина). И, что не менее важно, высокие концентрации аммиака, в отличие от других показателей, сохранялись и после окончания всего тренировочного цикла.
В работе S.R.Camerino и соавторов[19] показано увеличение аммиака на 70% в плазме крови в течение 2-х часового интенсивного непрерывного тренинга при максимальной нагрузке на велотренажере у велосипедистов. В исследовании E.S.Prado и соавторов (2011) в процессе 2-х часового теста на велотренажере уровень аммониемии достигал 35% от исходных значений (на 30-ой минуте – более 20%, с 60-ой по 120-ую минуты – 30-35%) с последующим резким снижением к 150-180 минутам (30-60 минут периода отдыха после нагрузки). Параллельно в те же временные периоды нарастала концентрация мочевины (до 30-35%), но без снижения после окончания нагрузки.
Читайте также
- Протеин
- Гипертрофия мышц
- Анаболические процессы
- Протеин - вред и побочные эффекты
- Кетоаналоги аминокислот
Источники
- ↑ Lowenstein J.M. Ammonia production in muscle and other tissues: the purine nucleotide cycle. Physiol.Rev., 1972, 52:382-414.
- ↑ 2,0 2,1 Much B.J.C., Banister E.W. Ammonia metabolism in exercise and fatigue; a review. Med.Sci.Sports Exerc., 1983, 15(1):41-50.
- ↑ Brouns F., Beckers E., Wagenmakers A.J.M., Saris W.H.M. Ammonia accumulation during highly intensive long-lasting cycling: individual observations. Int.J.Sports Med., 1990, 11(Suppl.2): S78-S84.
- ↑ 4,0 4,1 Wilkinson D.J., Smeeton N.J., Watt P.W. Ammonia metabolism, the brain and fatigue; revisiting the link. Prog.Neurobiol., 2010, 91(3):200-219.
- ↑ Parnas J.K. Ammonia formation in muscle and its source. Am.J.Physiol., 1929. 90, 467.
- ↑ Babij P., Matthews S., Rennie M. 1983. Changes in blood ammonia, lactate and amino acids in relation to workload during bicycle ergometer exercise in man. Eur.J Appl.Physiol., 1983, 50: 405–411.
- ↑ Buono M.J., Clancy T.R., Cook J.R. Blood lactate and ammonium ion accumulation during graded exercise in humans. J. Appl. Physiol., 1984, 57, 135–139.
- ↑ Wagenmakers A.J., Coakley J.H., Edwards R.H., 1990. Metabolism of branchedchain amino acids and ammonia during exercise: clues from McArdle’s disease. Int.J.Sports Med., 1990, 11 (Suppl. 2): S101– S113.
- ↑ van Hall G., van der Vusse G.J., Soderlund K., Wagenmakers A.J. Deamination of amino acids as a source for ammonia production in human skeletal muscle during prolonged exercise. J. Physiol., 1995, 489 (Pt 1), 251–261.
- ↑ Banister E.W., Rajendra W., Mutch B.J.C. Ammonia as an indicator of exercise stress: Implication of recent findings to sports medicine. Sports Med., 1985, 2, 34–46.
- ↑ Banister E.W., Cameron B.J.C. Exercise-induced hyperammonaemia: peripheral and central effects. Int. J. Sports Med., 1990, 11, S129–S142.
- ↑ Brookes G.A. Amino acid and protein metabolism during exercise and recovery. Med.Sci.Sports Exercise, 1987, 19, S150–S156.
- ↑ Brosnan J.T., Brosnan M.E. Branched-chain amino acids: enzyme and substrate regulation. J. Nutr., 2006, 136, 207S–211.
- ↑ Shimomura Y., Honda T., Shiraki M. et al. Branched-chain amino acid catabolism in exercise and liver disease. J.Nutr., 2006, 136: 250S–253.
- ↑ Shimomura Y., Murakami T., Nakai N. et al. Exercise promotes BCAA catabolism: effects of BCAA supplementation on skeletal muscle during exercise. J.Nutr., 2004, 134: 1583S–1587S.
- ↑ Nybo L., Dalsgaard M.K., Steensberg A. et al. Cerebral ammonia uptake and accumulation during prolonged exercise in humans. J.Physiol., 2005, 563: 285–290.
- ↑ Yges C., Urena R., Leon C. et al. Blood ammonia response during incremental and steady-state exercise in military staff. Aviat.Space Environ.Med., 1999, 70(10):1007-1011.
- ↑ Coelho W.S., de Castro L.V., Deane E. et al. Investigating the Cellular and Metabolic Responses of World-Class Canoeists Training: A Sportomics Approach. Nutrients, 2016, 8:719-736.
- ↑ Camerino S.R., Lima R.C., Franca T.C. et al. Keto analogue and amino acid supplementation and its effects on ammonemia and performance under thermoneutral conditions. Food Funct., 2016, 7(2):872-880.