Почки
Категория:
«Фармакология».
Содержание
- 1 ФИЗИОЛОГИЯ ПОЧЕК
- 2 ПАТОФИЗИОЛОГИЯ ПОЧЕК И ТЕРАПЕВТИЧЕСКИЕ ЦЕЛИ
- 2.1 Регуляция водного обмена
- 2.2 Ингибиторы карбоангидразы
- 2.3 Петлевые диуретики
- 2.4 Тиазидные и тиазидоподобные диуретики
- 2.5 Различия между тиазидными и тиазидоподобными диуретиками
- 2.6 Калийсберегающие диуретики
- 2.7 Эплеренон
- 2.8 Антагонисты альдостерона
- 2.9 Осмотические диуретики
- 2.10 Полиурия
- 2.11 Терапевтическая направленность на рецепторы вазопрессина при полиурии
- 3 Синдром избыточной выработки вазопрессина
- 4 Почечнокаменная болезнь
- 5 Гиперурикемия
- 6 Олигурия
- 7 Хроническая почечная недостаточность
- 8 Гломерулонефрит
- 9 Диализ и лекарственная терапия
- 10 Нефротоксичные препараты
- 11 Читайте также
- 12 Литература
ФИЗИОЛОГИЯ ПОЧЕК[править | править код]
Главные функции почек:
- выделение азотсодержащих веществ типа мочевины и креатинина( см. Почки как орган выделения);
- регуляция объема внеклеточной жидкости;
- регуляция концентрации различных ионов;
- регуляция pH в организме.
Система выделения включает почки, мочевыводящие пути и мочевой пузырь, где моча накапливается перед выделением через уретру.
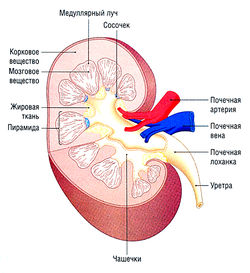
Почка имеет две области: корковую и мозговую
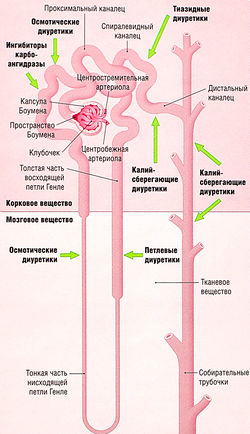
На продольном разрезе почки визуально различимы две области: темная внешняя кора и более бледная внутренняя часть — мозговое вещество, которое далее делится на 7-10 конических пирамид (рис. 12.1).
Функциональная единица каждой почки — нефрон. Каждая почка содержит ~ 1 млн нефронов. Нефрон — закрытая с одного конца трубка, образующая капсулу Боумена, окружающую капиллярный узел (клубочек). Клубочковые капилляры получают кровь из приносящей артериолы — резистивного кровеносного сосуда. Кровь покидает клубочек не через вену (емкостный сосуд), а через второй резистивный сосуд — выносящую артериолу. Такое устройство приносящих и выносящих сосудов почки формирует гидростатическое давление, осуществляющее ультрафильтрацию (см. далее). Другие части нефрона — проксимальный каналец, петля Генле, дистальный каналец и собирательная трубочка (см. рис. 12.6). Множество дистальных канальцев соединяются в собирательные трубочки, которые сливаются перед выходом в почечные чашечки, и, наконец, в почечную лоханку.
Существует два вида нефронов: корковые и юкстамедуллярные
- Корковые нефроны (85% всех нефронов) имеют клубочки во внешних 2/3 коры с короткими петлями Генле, которые уходят на короткое расстояние вглубь мозгового вещества или не достигают его. Выносящие артериолы корковых нефронов формируют сеть околоканальцевых капилляров, которые окружают все части нефрона.
- Юкстамедуллярные нефроны (15% всех нефронов) имеют клубочки во внутренней 1/3 коры с длинными петлями Генле, уходящими глубоко в мозговое вещество (см. рис. 12.6), и отвечают за образование гипертонической жидкости в пределах тканевого мозгового вещества. Выносящие артериолы юкстамедуллярных нефронов дают начало околоканальцевым капиллярам, а также формируют ряд сосудистых петель, которые спускаются в мозговое вещество и окружают петлю Генле.
'Моча' — модифицированный ультрафильтрат плазмы, продуцируемый тремя фильтрационными барьерами
Давление крови, обусловливающие ультрафильтрацию (т.е. фильтрацию молекул небольшого размера), — клубочковое гидростатическое капиллярное давление. Это давление зависит от отношения сопротивления в приносящей артериоле к сопротивлению в выносящей артериоле. В отличие от других сосудистых систем присутствие выносящей артериолы гарантирует, что гидростатическое давление в клубочковых капиллярах уменьшается по их длине постепенно.
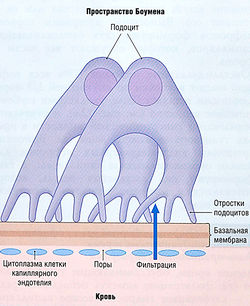
Ультрафильтрация начинается от клубочковых капилляров в капсуле Боумена и проходит через три барьера:
- клетки эндотелия клубочковых капилляров, которые содержат многочисленные фенестрации (поры диаметром 60 нм) и действуют как фильтрующий барьер только для клеток крови (рис. 12.2);
- базальная мембрана находится сразу под клетками эндотелия, состоит из коллагена и других гликопротеинов. Это главный фильтрационный барьер, через который проходят только молекулы определенных размеров и заряда;
- подоциты — специализированные клетки капсулы Боумена с многочисленными отростками, покрывающими базальную мембрану. Промежутки между связанными друг с другом отростками смежных подоцитов образуют еще один барьер для отрицательно заряженных макромолекул (см. рис. 12.2).
Молекулы массой 70 кДа и более не могут подвергаться ультрафильтрации. Они остаются в клубочковых капиллярах приносящих сосудов. Напротив, молекулы менее 7 кДа (например, глюкоза, аминокислоты, ионы Na+ и К+) свободно фильтруются и поступают в ближайшую трубочку в концентрациях, сходных с концентрацией в крови.
Вещества массой 7-70 кДа фильтруются пропорционально их молекулярной массе. Заряд на молекуле также может влиять на фильтрацию, т.к. базальная мембрана и подоциты имеют отрицательные заряды, отталкивающие анионные макромолекулы. Это относится к несущему отрицательный заряд альбумину (69 кДа), который фильтруется в меньшей степени, чем можно было бы ожидать при его массе.
Изменения ультрафильтрата в канальцах
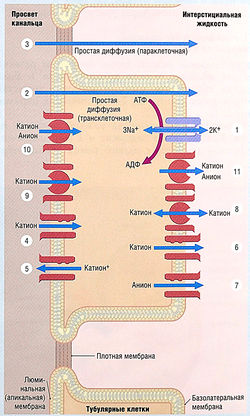
Ультрафильтрат поступает в почечные канальцы и там модифицируется серией реабсорбционных и секреторных процессов на протяжении всей длины нефрона (рис. 12.3). Эти процессы используют следующие транспортные механизмы:
- активный транспорт, расходующий энергию гидролиза АТФ (см. рис. 12.3);
- простую диффузию с использованием трансклеточных (через клетки) или параклеточных (через плотные связки между клетками) путей;
- транспорт по ионным каналам;
- котранспорт веществ через мембрану в одном направлении (симпорт);
- контртранспорт веществ в противоположных направлениях (антипорт).
Рис. 12.3 Транспортные механизмы в клетках почечных канальцев. Растворы перемещаются по клеткам с помощью активного транспорта (процесс, включающий гидролиз АТФ) (1); с помощью диффузии (2, В); по ионным каналам (4-7); с помощью контртранспорта (через мембрану в противоположном направлении) (8, 9) и котранспорта (через мембрану в том же направлении) (10, 11). АДФ — аденозиндифосфат; АТФ — аденозинтрифосфат.
Белки ионного канала формируют поры в мембранах, позволяя проходить ионам Na+ или К+. Транспортные белки также могут проходить через мембрану, увлекая за собой несколько ионов или молекул. После связывания молекула транспортера конформационно изменяется. Подобное движение ионов через мембрану требует конформационного изменения ионного канала, поэтому транспортные белки перемещают ионы по мембранам клеток примерно в 1000 раз медленней, чем по каналам.
Многие транспортные механизмы непосредственно не связаны с гидролизом АТФ, но зависят от электрохимических градиентов активного транспорта Na+ и К+ через базолатеральную мембрану. Градиент создается Nа+/К+-АТФазой, которая выкачивает из клетки три иона Na+ и закачивает два иона К+. Nа+/К+-АТФаза запускает реабсорбцию Na+ и котранспорт веществ типа глюкозы через апикальную мембрану. Детально транспортные механизмы в различных отделах нефрона описаны далее в связи с механизмами действия мочегонных лекарственных средств.
ПАТОФИЗИОЛОГИЯ ПОЧЕК И ТЕРАПЕВТИЧЕСКИЕ ЦЕЛИ[править | править код]
Читайте основную статью: Отеки
Регуляция водного обмена[править | править код]
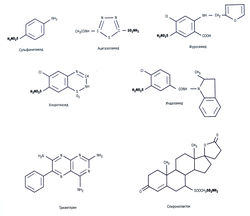
Диурез — процесс увеличения объема мочи, которым управляют гомеостатические механизмы тела и на который можно повлиять с помощью лекарств. Мочегонные средства — лекарства, увеличивающие выделение почками Na+, Cl" и воды. Механизм действия многих диуретиков заключается в уменьшении реабсорбции Na+, следствием чего будет увеличенная потеря Сl и воды. Сульфаниламиды — мочегонные средства (рис. 12.5), обладающие не только мочегонным, но и антидиабетическим эффектами.
Все мочегонные средства, кроме осмотических, действуют непосредственно на клетки почечных канальцев на определенных участках нефрона (рис. 12.6). Для большинства этих лекарств механизм действия локализован на апикальной мембране клеток канальцев, действие препаратов проявляется после гломерулярной фильтрации мочегонного средства в проксимальный каналец. Исключение — антагонисты альдостерона, которые действуют на свои внутриклеточные мишени после диффузии через базолатеральную мембрану дистальных канальцев.
Читайте основную статью: Гомеостаз жидкостей организма
Ингибиторы карбоангидразы[править | править код]
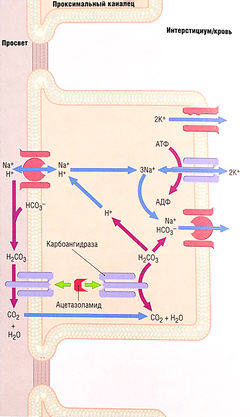
Создание этих лекарственных средств стало результатом наблюдения, что сульфаниламиды вызывают умеренный диуретический эффект и метаболический ацидоз. Прототипом этой подгруппы мочегонных средств является ацетазоламид, первичная локализация механизма действия которого — проксимальный каналец. Имеется и вторичный участок локализации действия — в собирательной трубочке, где карбоангидраза участвует в выработке кислоты (см. рис. 12.10).
Карбоангидраза расположена в цитоплазме проксимальных клеток канальцев и в апикальной мембране клетки. Этот фермент участвует в реабсорбции натрия и бикарбоната, как показано на рис. 12.7. Ацетазоламид может максимально увеличить выделение Na+ на 5%, но обычно оно увеличивается на 1% или еще меньше. Ассоциированная потеря бикарбоната с мочой приводит к ее закислению и, как следствие, метаболическому ацидозу. Однако развитие метаболического ацидоза самоограничивается по мере того, как уменьшается количество бикарбоната. Кроме того, усиление диуреза с помощью ацетазоламида краткосрочно, т.к. уменьшение фильтрации бикарбоната понижает эффективность препарата в отношении подавления реабсорбции Na+. Как и другие мочегонные средства, которые вызывают увеличение транспорта Na+ в собирательные трубочки, ацетазоламид увеличивает выделение К+, что может привести к гипокалиемии (табл. 12.1-12.3).
Ацетазоламид может уменьшить отеки при застойной сердечной недостаточности, но с этой целью его применяют редко. Ацетазоламид главным образом используют не в связи с заболеваниями почек, а, например, при глаукоме, когда подавление карбоангидразы уменьшает образование внутриглазной жидкости.
Читайте основную статью: Ингибиторы карбоангидразы
Петлевые диуретики[править | править код]
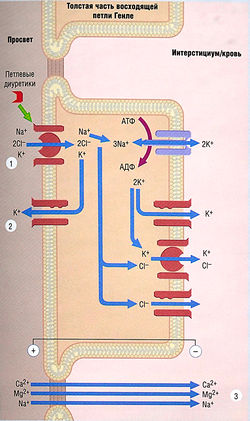
Исследования аналогов сульфонамида привели к разработке подгруппы диуретиков, действующих на петлю Генле. К этим петлевым мочегонным средствам относят фуросемид (см. рис. 12.5), буметанид и торсемид. Этакриновая кислота, производное феноксиуксусной кислоты, оказывает диуретический эффект на петлю Генле, ингибируя котранспорт ионов Na+, К+ и Сl' (стехиометрия 1:1:2) через апикальную мембрану толстой части восходящей петли Генле, связывая и подавляя образование специфического транспортного белка (буметанид-чувствительный котранспорт-1) (рис. 12.8). Петлевые диуретики — самые эффективные из всех мочегонных средств: способны увеличить выделение Na+ на 15-25%.
Толстая часть восходящей петли Генле непроницаема для воды, поэтому движение ионов Na+ и Сl- в тканевом веществе мозгового вещества (см. рис. 12.6) без сопутствующей воды увеличивает осмотическое давление в этой области. Высокое осмотическое давление в тканевом веществе вызывает реабсорбцию воды из собирательных трубочек, но только в присутствии антидиуретического гормона (типа вазопрессина) (см. далее). Петлевые диуретики ингибируют реабсорбцию воды из собирательных трубочек путем уменьшения ионной концентрации в тканевом веществе.
Рис. 12.6 Нефрон, собирательные трубочки и места действия диуретических средств. Основные функциональные единицы почек — это нефроны, фильтрующие кровь в клубочках. Полученный инфильтрат модифицируется серией реабсорбтивных и секреторных процессов по мере прохождения по нефрону перед тем, как попасть в собирательные трубочки и затем в почечную лоханку.
Реабсорбция Са2+ и Mg2+ также подавляется петлевыми диуретиками, т.к. абсорбция этих ионов вызывается мембран-положительным потенциалом, возникающим при транспорте К+ через апикальную мембрану по К+-селективным ионным каналам (см. рис. 12.8). Петлевые диуретики увеличивают поставку Na+ в собирательные трубочки, что усиливает выделение К+ и Н+, приводя к гипокалиемическому алкалозу.
Петлевые диуретики — водорастворимые слабые кислоты, в лечебных концентрациях высокосвязанные с альбумином плазмы крови (> 90%). Фуросемид в основном выделяется почками в результате транспорта в проксимальных канальцах (см. табл. 12.3). Буметанид и торсемид в значительной степени перерабатываются в печени, поэтому при почечной недостаточности накапливаются меньше, чем фуросемид, и, значит, риск побочного действия буметанида и торсемида меньше.
Кроме мочегонного действия, петлевые диуретики косвенно оказывают венорасширяющее действие из-за изменения выработки почками регуляторных веществ (вероятнее всего простагландина). Это приводит к снижению давления в полости левого желудочка сердца и помогает снизить отек легких.
Фуросемид (в дозе 20-80 мг внутрь) действует в течение часа; его эффект завершается в течение 6 час. Таким образом, фуросемид можно принимать 2 раза в день, не опасаясь, что диурез приведет к нарушению сна. Дозировка 1 раз в день оставляет 18-часовой промежуток, когда почки могут повторно поглощать Na+, восстанавливая задержку Na+, которая может быть достаточно сильной, чтобы свести на нет предшествующий диурез. Этого можно избежать, если вводить фуросемид путем непрерывной внутривенной инфузии.
Рис. 12.7 Реабсорбция гидрокарбоната натрия в проксимальных канальцах и места действия ингибитора карбоангидразы ацетазоламида. Контртранспорт Na+ и Н+ через апикальную мембрану транспортирует Na+ в клетку, а Н+ — в просвет канальца. Последний реагирует с бикарбонатом (НС03-), образуя угольную кислоту (Н2С03), которая разлагается, образовывая С02 и Н20. Эту реакцию катализирует карбоангидраза апикальной мембраны. Как С02, так и Н20 легко проходят в клетку, где благодаря действию цитоплазматической карбоангидразы образуется угольная кислота. Угольная кислота разлагается на ион НС03~, который транспортируется с Na+ через базолатеральную мембрану, и Н+. Последний движется через мембрану контртранспортом Na+/H+, начиная цикл снова. Ингибирование мембранных и цитоплазматических форм карбоангидразы ацетазоламидом подавляет реабсорбцию Na+ и НСО3-. АДФ — аденозиндифосфат; АТФ — аденозин-трифосфат.
Рис. 12.8 Транспортные механизмы в толстой части восходящей петли Генле. Петлевые диуретики блокируют котранспорт Na+/K+/2Ch (1), таким образом предотвращая абсорбцию и повышая канальцевое выведение Na+ и Ch. Эти средства также уменьшают разницу потенциалов на канальцевых клетках путем выведения К+ (2). В результате повышается выведение Са2+ и Мд2+ из-за подавления параклеточной диффузии (3). Знаки + и - указывают на разность потенциалов. АДФ — аденозиндифосфат; АТФ — аденозинтрифосфат.
Клинические показания для петлевых диуретиков:
- острый отек легких. Для гарантированного быстрого эффекта препарат вводят внутривенно.
При застойной сердечной недостаточности с отеком легких или без него фуросемид обычно применяют перорально, чтобы уменьшить симптомы сердечной недостаточности и увеличить длительность действия (см. главу 13);
- другие отечные состояния — нефротический синдром, асцит при циррозе печени и хронической почечной недостаточности (прием перорально);
- гипертензия у пациентов, которые резистентны к другим мочегонным или противогипертоническим препаратам, особенно у пациентов с почечной недостаточностью;
- острая почечная недостаточность. Применяют для увеличения образования мочи;
- гипонатриемия, которая может вызвать отек мозга, что приведет к неврологической дисфункции, выражающейся в летаргии, спутанности сознания и даже коме.
Петлевые диуретики снижают концентрацию раствора жидкости в тканевом веществе. Это обеспечивает дополнительное выведение воды относительно выделения Na+ и делает целесообразным применение петлевых диуретиков вместе с гипертоническим солевым раствором в лечении гипонатриемии.
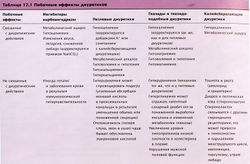
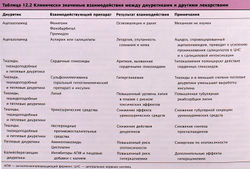
Основные побочные эффекты петлевых диуретиков и примеры их взаимодействия с другими лекарствами перечислены в табл. 12.1, 12.2.
Тиазидные и тиазидоподобные диуретики[править | править код]
К диуретикам подгруппы тиазидов относят бендрофлуметиазид, хлоротиазид, политиазид и гидрохлоротиазид. Тиазидоподобные мочегонные средства (индапамид, хлорталидон и метолазон) имеют сходный механизм действия, но другую химическую структуру. Все тиазидные и тиазидоподобные мочегонные средства имеют сходство с сульфонамидами (см. рис. 12.5).
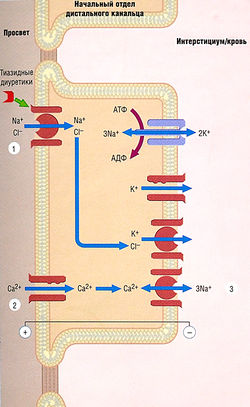
Молекулярный механизм действия тиазидных диуретиков — ингибирование котранспорта Na+/Cl" (тиазидочувствительный котранспорт) в дистальных извитых канальцах почек (рис. 12.9). По сравнению с петлевыми диуретиками тиазиды имеют умеренную эффективность. Одна из причин — физиологическая: к тому моменту, когда фильтрат достигает дистальных извитых канальцев, 90% отфильтрованного Na+ реабсорбируются. Действие тиазидов приводит к выделению с мочой 50% Na+, идущего к удаленным нефронам, т.е. 5% Na+ фильтруются в мочу. В отличие от петлевых диуретиков, применяемых для лечения потенциально фатальной гипонатриемии, тиазиды могут усугубить ее, т.к. они увеличивают выделение Na+, не изменяя способность почек концентрировать мочу.
Различия между тиазидными и тиазидоподобными диуретиками[править | править код]
При приеме внутрь тиазидные и тиазидоподобные диуретики всасываются хорошо и выводятся почками путем выделения в проксимальные канальцы (см. табл. 12.3). Однако значительная часть бендрофлуметиазида, политиазида и индапамида выделяется также путем метаболизма. Хлорталидон имеет настолько длительное действие, что его можно применять через день для контроля отеков. Индапамид отличается от других лекарств этой подгруппы тем, что снижает артериальное давление в дозах менее высоких, чем необходимо для диуреза (эффект, приписываемый блокаде кальциевых каналов L-типа). Кроме того, индапамид меньше влияет на закисление мочи и на усвоение глюкозы, чем другие препараты из этой подгруппы (см. табл. 12.1).
В отличие от петлевых диуретиков тиазиды уменьшают выделение Са2+. Точный механизм, лежащий в основе этого эффекта, неясен. В дистальных канальцах Са2+ повторно поглощается через эпителиальный кальциевый канал (ЕСаС), отличающийся по структуре и функции от других типов кальциевых каналов. Транспорт Са2+ через базальную мембрану осуществляется с помощью обменного контртранспорта Na+/Ca2+ (см. рис. 12.9). Поскольку внутриклеточная концентрация Na+ уменьшена вследствие первичного молекулярного действия тиазида, увеличение градиента концентрации Na+ на базолатеральной мембране может стать достаточным для увеличения выведения Са2+ через базальную мембрану посредством контртранспорта Na+/Ca2+. При этом наблюдается параллель с клеточным механизмом, посредством которого дигиталис действует на внутриклеточный уровень Са2+ в сердце при лечении сердечной недостаточности, косвенно влияющий на контртранспорт Na+/Ca2+.
Рис. 12.9 Транспортные механизмы в начальном отделе дистального канальца. Тиазидные диуретики повышают выделение Na+ и С1~ путем ингибирования котранспорта Na+/CI~ (1). Эти диуретики увеличивают реабсорбцию Са2+ (2) с помощью механизма, который может стимулировать контртранспорт Na+/Ca2+ (3) путем повышения градиента концентрации Na+ на базолатеральной мембране. Знаки + и - указывают на разность потенциалов. АДФ — аденозиндифосфат; АТФ — аденозинтрифосфат.
Фармакотерапевтическими показаниями для применения тиазидных диуретиков могут быть:
- отеки, возникающие при сердечной недостаточности, циррозе печени и нефротическом синдроме;
- гипертензия, при которой их используют как монотерапию или в комбинации с другими гипотензивными средствами. Клинические исследования показали, что максимальный эффект дает применение тиазидов в дозе, не превышающей 25 мг/сут гидрохлоротиазида или его эквивалента. Более высокие дозы ведут к большему диурезу без пропорционального снижения артериального давления, но при большем риске гипокалиемии, что предрасполагает к сердечным аритмиям типа фибрилляции желудочков и пароксизмальной желудочковой тахикардии;
- почечнокаменная болезнь (нефролитиаз).
Общие побочные эффекты тиазидов и петлевых диуретиков
Эти средства могут вызывать метаболический алкалоз и гипокалиемию, что происходит из-за увеличенного выделения К+ и Н+ в дистальных канальцах и собирательных трубочках, имеющих два типа клеток:
- базальные клетки — участки транспорта Na+, К+ и воды;
- вставочные клетки — участки выделения Н+ (рис. 12.10, 12.11).
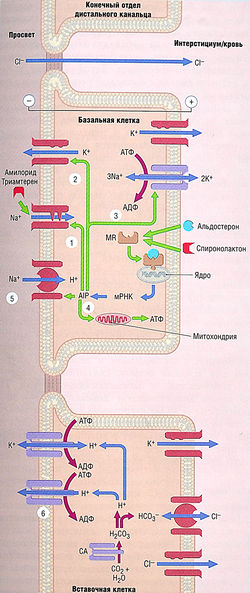
Реабсорбция Na+ через апикальную мембрану базальных клеток происходит главным образом через Na+-каналы. Такие амилорид-чувствительные эпителиальные Nа+-каналы (ENaC) отличаются по структуре и функциям от потенциал-зависимого Nа+-канала в нервах и сердечной мышце.
Эпителиальные Ка+-каналы обеспечивают высокую скорость транспорта Na+ при продвижении через апикальную мембрану и далее по электрохимическому градиенту, вырабатываемому Na+/K+-АТФазой в базолатеральной мембране (см. рис.12.10). Высокая скорость прохождения Na+ через апикальную мембрану приводит к ее деполяризации, что создает отрицательную разность потенциалов между клеткой и мембраной. Эта разность потенциалов обеспечивает движущую силу для выделения К+. К+ доставляется в клетку Na+/K+-АТФазой и перемещается через апикальную мембрану по К+-каналу ROMK-1 — внутримембранному каналу транспорта ионов натрия и калия (Na+/K+-насосу). К+, транспортируемый Ка+/К+-АТФазой, проходит через базолатеральную мембрану по К+-каналам.
Действие тиазидных и петлевых диуретиков приводит к увеличению концентрации апикального Na+ в дистальных канальцах и собирательных трубочках. Это повышает выделение К+, поскольку:
- увеличенное выделение Na+ приводит к повышению его реабсорбции, что увеличивает мембран-отрицательный потенциал, являющийся движущей силой для выделения К+;
- увеличение внутриклеточной концентрации Na+ в базальной клетке повышает активность Na+/K+-АТФазы; это приводит к росту содержания ионов К+, который становится доступным для выделения;
- увеличение диуреза в отдаленных от центра частях нефрона, вызываемое диуретиками, ведет к выделению К+. Таким образом поддерживается градиент его концентрации.
Кроме того, тиазидные и петлевые диуретики могут привести к уменьшению объема внеклеточной жидкости и снижению артериального давления, что стимулирует ренин-ангиотензиновую систему (см. главу 13). Эта система — первичный стимул для выработки альдостерона, гормона, способствующего выведению К+ (см. далее).
|
Таблица 12.3 Фармакокинетические параметры некоторых диуретиков | ||||||
|
Лекарственные средства |
Пути введения |
Всасывание (%) |
Т1/2 (час) |
Объем распределения (л/кг) |
Выведение |
Примечания |
|
Ацетазоламид |
п/о в/м в/в |
100 |
8(6-9) |
0,2 |
С мочой в неизмененном виде |
Пониженная доза для пожилых с почечной недостаточностью. Алкализация мочи может снизить выведение с мочой слабых оснований и увеличить их фармакологическое действие |
|
Фуросемид |
п/о в/м в/в |
52 (27-80) |
1,5 (0,5-2,0) |
0,2-0,3 |
Около 75% с мочой в неизмененном виде |
Прием с пищей уменьшает всасываемость |
|
Хлоротиазид |
п/о в/в |
7-33 |
1 5-27 |
0,3 |
С мочой в неизмененном виде |
Всасывание уменьшается с дозой |
|
Индапамид |
п/о |
Высокое |
17 (10-22) |
60 |
Экстенсивный метаболизм | |
|
Триамтерен |
п/о |
30-83 |
1,5-2,5 |
2,2-3,7 |
Быстрый метаболизм | |
|
Спиронолактон |
п/о |
60-70 |
1,3 ±0,3 (SD) |
Неизвестно |
Экстенсивный метаболизм |
Всасывание может меняться из-за плохой растворимости в воде, но улучшается после еды. Канренон — активный метаболит |
Вставочные клетки — участки транспорта Н+ с помощью или Н+-АТФазы, или Н+/К+-АТФазы. Ионы Н+ для этих транспортных ферментов вырабатывает карбоангидраза (см. рис. 12.10). Кроме того, имеется контртранспорт Na+/H+ в базальных клетках, который повторно поглощает Na+ в обмен на Н+. Что касается полной реабсорбции Na+, транспорт Na+/H+ в дистальных канальцах и собирательных трубочках не имеет большого значения по сравнению с такой же транспортной системой в проксимальных канальцах (см. ранее). Выделенный Н+ буферизируется в мембране такими ионами, как НСО3- и НРO42-.
Тиазидные и петлевые диуретики могут вызвать метаболический ацидоз из-за увеличенной потери Н+ с мочой и еще большей реабсорбции НС03". Это происходит поскольку:
- увеличение выделения Na+ в дистальные канальцы стимулирует обмен Na+ и Н+;
- увеличение На+-мембран-отрицательного потенциала вследствие увеличенной реабсорбции повышает выработку Н+-АТФазы;
- повышение секреции К+ из-за увеличения реабсорбции Na+ приводит к активации Н+/К+-АТФазы;
- повышение секреции альдостерона из-за сокращения объема крови приводит к увеличению активности ферментов, вовлеченных в выработку Н+ (см. рис. 12.10).
Калийсберегающие диуретики[править | править код]
Действуют на дистальные канальцы и собирательные трубочки
Калийсберегающие диуретики можно разделить на две группы:
- блокаторы каналов ENaC (триамтерен и амилорид — органические вещества, не содержащие сульфонамидной группы) (см. рис. 12.5);
- антагонисты альдостерона (спиронолактон и его метаболит канреноат калия), блокирующие минералокортикостероидные рецепторы, которые являются ДНК-связанными рецепторами. Спиронолактон имеет циклическую структуру, характерную для стероидов (см. рис. 12.5). Оба типа калийсберегающих диуретиков обладают слабым мочегонным действием, выводя 2-3% Na+, при этом степень диуреза, вызываемого антагонистами альдостерона, во многом зависит от его исходного уровня.
Блокада апикальных Nа+-каналов в базальных клетках амилоридом или триамтереном уменьшает транспорт Na+ через апикальную мембрану (см. рис. 12.10). Амилорид также ингибирует обмен Na+ и Н+, но в концентрациях намного выше тех, что нужны в терапевтических целях. Снижение амилоридом и триамтереном внутриклеточной концентрации Na+ уменьшает активность базолатеральной Nа+/К+ -АТФазы так, что в клетки транспортируется меньше ионов Na+ и К+. Сокращение транспорта Na+ через апикальную мембрану уменьшает мембран-отрицательную разность потенциалов и, следовательно, уменьшает градиент выведения К+. Таким образом, эффект этих лекарственных средств приводит к снижению реабсорбции Na+ и секреции К+. В связи с этим данные препараты называют калийсберегающими диуретиками, их применение может привести к развитию гиперкалиемии.
Рис. 12.10 Транспортные механизмы в конечном отделе дистального канальца и собирательных трубочках и места действия калийсберегающих диуретиков. Амилорид и триамтерен блокируют апикальные Ма+-каналы, приводя к снижению разности потенциалов на базальной клетке (отрицательный заряд на мембране по отношению к интерстициуму). Снижение разности потенциалов приводит к уменьшению движущей силы для выведения К+ из базальной клетки и выведения Н+ из вставочной клетки. Конечный эффект — увеличенное выведение Na+ и уменьшенное выведение К+ и Н+. Альдостерон связывается с цитоплазматическим минералокортикоидным рецептором (MR), приводя к стимуляции синтеза альдостерон-индуцированных белков (AIP), которые: (1) активируют «спящие» (нефункционирующие) Ма+-каналы; (2) увеличивают синтез К+-каналов; (В) увеличивают синтез Na+/K+-АТФазы; (4) увеличивают митохондриальную выработку АТФ;(5) увеличивают синтез контртранспорта Na+/H+; (б) увеличивают синтез Н+-АТФазы. Общий эффект этих изменений — уменьшение выведения Na+ и увеличение выведения К+ и Н+. Спиронолактон, антагонист альдостерона, оказывает обратное действие. Карбоангидраза (СА) также катализирует образование угольной кислоты в базальных клетках, образуя Н+ для контртранспорта Na+/H+. АДФ — аденозиндифосфат; АТФ — аденозинтрифосфат; мРНК — матричная рибонуклеиновая кислота.
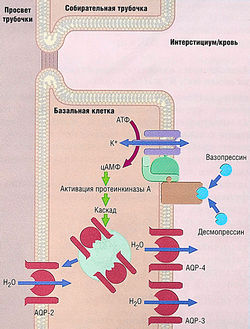
Рис. 12.11 Механизм регуляции проницаемости для воды собирательных трубочек. Вазопрессин или его аналог (например, десмопрессин) связываются с С-белок-связанными \/2-рецепторами на базолатеральной мембране базальных клеток в собирательных трубочках. Активация аденилилциклазы или протеинкиназы А приводит к перемещению везикул с предсформиро-ванными водными канальцами аквапорина-2 — (AQP-2) в апикальную мембрану. AQP-2 высвобождаются из везикул и встраиваются в мембрану, увеличивая таким образом ее водопроницаемость. Водные канальцы аквапорина-3 и -4 (AQP-3, AQP-4) в базолатеральной мембране обеспечивают проход воды в интерстициум. АТФ — аденозинтрифосфат; цАМФ — циклический аденозинмонофосфат.
Амилорид и триамтерен могут вызвать метаболический ацидоз
Мочегонное действие амилорида и триамтерена косвенно уменьшает секрецию Н+, что может привести к метаболическому ацидозу. Сокращение мембран-отрицательной разности потенциалов, вызываемое этими блокаторами ENaC, уменьшает секрецию Н+ посредством Н+-АТФазы, в то время как сокращение выведения К+ уменьшает выработку Н+ посредством К+/Н+-АТФазы.
Антагонизм с альдостероном влияет на обмен Na+, К+ и Н+ в почках
Клетки дистальных канальцев и собирательных трубочек имеют цитоплазматические рецепторы для минералокортикостероидов, которые, будучи связаны с альдостероном, мигрируют к ядру и начинают транскрипцию и трансляцию ДНК, что ведет к синтезу особых альдостерон-индуцированных белков. Эти белки:
- активируют «спящие» №+-каналы, заставляя их функционировать (точный механизм этого действия пока не ясен);
- увеличивают синтез К+-каналов;
- увеличивают синтез Nа+/К+-АТФазы;
- увеличивают митохондриальную выработку АТФ;
- увеличивают синтез контртранспорта Na+/H+;
- увеличивают синтез Н+-АТФазы (см. рис. 12.10). Конечный эффект альдостерона — увеличение реабсорбции Na+ и выведения К+ и Н+.
Спиронолактон косвенно уменьшает реабсорбцию Na+ и выработку К+ и Н+
Спиронолактон — конкурентный ингибитор связывания альдостерона с его рецепторами (см. рис.12.10), блокирующий стимуляцию синтеза белков, которые изменяют транспортные функции дистальных канальцев и собирательных трубочек. Действие спиронолактона направлено на снижение реабсорбции Na+ и выработки К+ и Н+. Последнее может привести к гиперкалиемии и метаболическому ацидозу.
Минералокортикостероидные рецепторы представлены не только в эпителиальных клетках, но также и в таких тканях, как мозг, сердце и кровеносные сосуды. Длительная стимуляция этих рецепторов в сердце и кровеносных сосудах альдостероном, как было доказано, опасна, т.к. вызывает фиброз и гипертрофию. Спиронолактон повышает выживаемость пациентов с тяжелой сердечной недостаточностью, если добавлять его к их обычному лечению, например ингибиторами ангиотензинпревращающего фермента. Такой эффект в большей степени связан с блокадой рецепторов в неэпителиальных клетках почек.
И амилорид, и триамтерен эффективны при приеме перорально, хотя амилорид выводится с мочой преимущественно в неизмененном виде, а триамтерен трансформируется печенью до активного метаболита 4-гидрокситриамтерена. Спиронолактон при приеме внутрь хорошо абсорбируется и метаболизируется в печени (см. табл. 12.3). Спиронолактон имеет короткий период полувыведения (1,3 час), но трансформируется в длительно действующий активный метаболит канренон (период полувыведения — 17 час), который продлевает мочегонный эффект.
КЛИНИЧЕСКИЕ ПОКАЗАНИЯ. Триамтерен, амилорид и спиронолактон используют в комбинации с некалийсберегающими диуретиками (тиазидными и петлевыми) для сохранения баланса К+. Включение калийсберегающих диуретиков в терапию мочегонными средствами — альтернатива использованию добавок К+ к некалийсберегающим диуретикам. Амилорид и триамтерен используют в комбинации с тиазидными и петлевыми диуретиками для лечения отеков, связанных с сердечной недостаточностью и заболеваниями печени. Пример такой диуретической комбинации — 50 мг триамтерена и 40 мг фуросемида в одной таблетке, прием от 0,5 до 2 таблеток 1 раз в сутки. Эти препараты также используют в комбинации с тиазидами при лечении гипертензии, но только при развитии гипокалиемии.
Эплеренон[править | править код]
Эплеренон — селективный антагонист альдостерона. Преимущество препарата перед спиронолактоном заключается в том, что эплеренон более селективен по отношению к рецепторам альдостерона, чем спиронолактон, и поэтому имеет меньше побочных эффектов, связанных с действием на рецепторы половых гормонов (например, гинекомастия).
Антагонисты альдостерона[править | править код]
Применяют при лечении следующих заболеваний:
- первичный альдостеронизм (синдром Конна) — опухоль надпочечника, вырабатывающая большие количества альдостерона, что ведет к гипертензии, гипокалиемии и увеличению объема внеклеточной жидкости. Это заболевание можно лечить, ограничивая употребление пищи с Na+ и принимая спиронолактон (100-200 мг/сут), хотя побочные эффекты ограничивают длительное применение спиронолактона (см. табл. 12.1). Хирургическое удаление опухоли — более эффективный способ лечения;
- вторичный альдостеронизм — увеличенная выработка альдостерона в ответ на активацию ренин-ангиотензиновой системы, что происходит при гипертензии из-за перепроизводства ренина или вследствие отека (см. ранее),
- хроническая сердечная недостаточность — прежде всего для экстраренального действия (см. ранее, а также главу 13).
Осмотические диуретики[править | править код]
Осмотические диуретики маннитол (для внутривенного введения) и изосорбид (для перорального введения) свободно фильтруются в клубочках и не реабсорбируются. Это редкий пример лекарственнных веществ, эффект которых обусловлен не специфической молекулярной целью, а физико-химическими свойствами. Осмотические диуретики повышают осмотическое давление в почечных канальцах, таким образом уменьшая реабсорбцию воды и Na+ в проксимальных канальцах и тонкой части нисходящей петли Генле. Осмотические диуретики увеличивают внеклеточный объем жидкости, в результате потеря внутриклеточной воды становится больше, что тормозит выброс ренина и уменьшает вязкость крови, а это в свою очередь увеличивает почечный кровоток. Кроме того, почечная вазодилатация и последующее увеличение почечного кровотока, вызванные осмотическими диуретиками, могут привести к выбросу простагландинов. Увеличение почечного кровотока усугубляет мочегонное действие, уменьшая почечную гипертензию. При парентеральном введении маннитол ограничивается внеклеточными пространствами, не депонируется и быстро выводится почками. Приблизительно 80% первоначально введенной дозы выводятся с мочой в течение 3 час. Маннитол свободно фильтруется в клубочках и реабсорбируется в канальцах менее чем на 10%.
КЛИНИЧЕСКИЕ ПОКАЗАНИЯ. Осмотические диуретики используют нечасто из-за большей терапевтической эффективности других мочегонных средств. Иногда осмотические диуретики применяют при терапии олигурии (см. далее), но не для лечения отеков. У пациентов с сердечной недостаточностью эти препараты могут вызвать отек легких в результате быстрого перераспределения воды из внутриклеточного пространства во внеклеточное и увеличения объема циркулирующей крови. Из-за повышения осмотического давления плазмы осмотические диуретики вызывают отток воды из тканей глаз и головного мозга. Этот эффект используют при лечении острых приступов глаукомы и для снижения повышенного внутричерепного давления при отеке мозга. Такое применение не связано с действием осмотических диуретиков на почки, т.к. полезный эффект прекращается после фильтрации в почках.
Полиурия[править | править код]
Полиурия — чрезмерное выделение мочи, которое обычно сопровождается полидипсией (патологически повышенной жаждой). Главные причины полиурии:
- несахарный диабет, вызываемый либо нарушением выработки достаточного количества вазопрессина (центральный несахарный диабет), либо тем, что собирающие канальцы не в состоянии ответить на действие вазопрессина (нефрогенный несахарный диабет).
Механизмы действия диуретиков
- Петлевые диуретики блокируют симпорт Na+/K+/2CI в толстой части восходящей петли Генле, приводя к выделению 15-25% Na+
- Диуретики подгруппы тиазидов блокируют котранспорт Na+/CI~ в дистальном извитом канальце, приводя к выделению 5% Na+
- Калийсберегающие диуретики увеличивают выделение Na+ на 2-3% и уменьшают выделение К+, действуя на дистальные канальцы и собирательные трубочки
- Калийсберегающий диурез вызывает блокада Nа+-каналов (например, амилоридом или триамтереном) или блокада цитоплазматических минералокортикостероидных рецепторов (например, спиронолактоном)
- Осмотические диуретики уменьшают реабсорбцию воды, приводя к уменьшению реабсорбции Na+ в проксимальных канальцах и тонкой части нисходящей петли Генле
- Ингибиторы карбоангидразы косвенно блокируют обмен Na+/H+ в проксимальных канальцах, что приводит к выделению до 5% Na+
Терапевтическая направленность на рецепторы вазопрессина при полиурии[править | править код]
Антидиуретический гормон (ADH), также известный как 8-аргинин-вазопрессин, является нонапептидом, вырабатываемым в заднем отделе гипофиза в ответ на увеличение осмоляльности плазмы или снижение объема крови и/или артериального давления. Есть два подтипа рецепторов ADH — V1 и V2, оба они связаны с G-белком. Возбуждение V1рецепторов вызывает сокращение гладких мышц, особенно сосудов. Через V2-рецепторы вазопрессин влияет на проницаемость для воды собирательных трубочек нефрона. Сходство V2-рецепторов с ADH больше, чем с V1рецепторами, поэтому изменения артериального давления наблюдаются при более высоких дозах, чем нужно для действия на почки.
Другие агонисты ADH, используемые для лечения несахарного диабета:
- липрессин (8-лизин-вазопрессин) — неселективный агонист с вазопрессин-подобной активностью и продолжительностью действия, вводят назально в форме спрея;
- десмопрессин (1-деамино-8-D-аргинин-вазопрессин) — ~ в 3000 раз более селективен к V2-peцепторам и имеет большую продолжительность действия (T1/2 = 75 мин), чем вазопрессин (Т1/2 = 10 мин).
Действие ADH направлено на увеличение количества водных канальцев (аквапор) в апикальной мембране собирательных трубочек. Он увеличивает их водопроницаемость, а в его отсутствие собирательные трубочки непроницаемы для воды. Вазопрессин связывается с V2-рецепторами на базолатеральной мембране базальных клеток собирательных трубочек (см. рис. 12.11). Эти рецепторы предположительно связаны с аденилилциклазой, синтезирующей цАМФ, которая активирует протеинкиназу А. С помощью фосфорилирования белков, индуцированного протеинкиназой, запускается образование вакуолей, содержащих предсформированные водные канальцы, в апикальной мембране, где происходит экзоцитоз вакуолей и встраивание канальцев в мембрану. Дальнейшее действие активации протеинкиназы А — уменьшение степени удаления водных канальцев от мембраны. Общий эффект активации V2-рецептора — увеличение количества водных канальцев и увеличение водопроницаемости. Как было упомянуто ранее, белки водных канальцев называют аквапоринами, а белок апикальной мембраны собирательной трубочки — аквапорином-2 (AQP-2). Базальная мембрана также имеет водные канальцы, позволяющие воде выходить в тканевое вещество; эти канальцы имеют аквапорины 3 и 4 типа (AQP-3 и AQP-4) (см. рис. 12.11).
Десмопрессин — препарат, используемый для лечения центрального несахарного диабета. Применение десмопрессина при центральном и нефрогенном несахарном диабете различно. Препарат увеличивает осмолярность мочи у пациентов с центральным несахарным диабетом, но оказывает слабый эффект при нефрогенной форме диабета. Десмопрессин в форме назального спрея — препарат выбора для лечения центрального несахарного диабета и для большинства пациентов, лечение которых должно быть пожизненным. Разовая назальная доза (10-40 мкг) действует в течение 6-20 час и не оказывает сосудосуживающего действия, в отличие от аргинин-вазопрессина и липрессина, из-за низкой аффиности V1рецепторов. Если использование в форме назального спрея невозможно, десмопрессин можно применять внутрь или подкожно.
Липрессин также применяют в форме назального спрея, но препарат имеет короткую продолжительность действия — 4-6 час. Поскольку липрессин является неселективным агонистом, он может вызвать эффекты активации V1рецептора типа сужения кожных сосудов и повышенную моторику кишечника (отрыжку и спастические боли в животе). Для пациентов, не реагирующих на десмопрессин, липрессин является хорошей альтернативой.
Аргинин-вазопрессин не используют для длительного применения из-за его короткого периода действия и эффектов, опосредованных V1-рецептором. Аргинин-вазопрессин является альтернативой десмопрессину при лечении пациентов с подозрением на несахарный диабет и для терапии переходной полиурии; вводят — внутривенно, подкожно или внутримышечно.
У некоторых пациентов с полиурией вазопрессин вырабатывается, но в недостаточных количествах (частичный центральный несахарный диабет). Для терапии используют негормональные средства — хлорпропамид или карбамазепин. Они усиливают антидиуретическое действие вазопрессина, но механизмы, ответственные за этот эффект, неясны.
Десмопрессин также эффективен при лечении никтурии, особенно у пожилых людей. Его основное побочное действие — гипонатриемия.
Нефрогенный несахарный диабет лечат тиазидными диуретиками длительного действия и индометацином. У некоторых пациентов нефрогенный несахарный диабет обусловлен мутациями V1рецептора, или аквапорина-2, в таких случаях полиурию нефрогенного несахарного диабета можно лечить тиазидами длительного действия (например, хлоротиазидом) — одним препаратом или в комбинации с амилоридом. Амилорид предотвращает развитие гипокалиемии и особенно полезен при лечении литий-индуцированного нефрогенного несахарного диабета (см. далее). Ингибитор циклооксигеназы индометацин также уменьшает поли-урию несахарного диабета; препарат используют вместе с тиазидными диуретиками.
Парадоксальное антидиуретическое действие тиазидов и индометацина при нефрогенном несахарном диабете можно объяснить следующим образом:
- реакция на тиазиды начинается с уменьшения объема крови, при этом увеличивается онкотическое давление белков плазмы и уменьшается гидростатическое давление в перитубулярных капиллярах проксимальных канальцев. Это благоприятствует реабсорбции Na+ и воды в этой части нефрона, уменьшает поступление жидкости в собирательные трубочки и снижает полиурию;
- индометацин ингибирует ЦОГ-1, снижает уровень клубочковой фильтрации и увеличивает реабсорбцию воды из проксимальных и дистальных канальцев. Кроме того, он усиливает действие вазопрессина на собирательные трубочки. Простагландины уменьшают действие вазопрессина в присутствии активированного V2-рецептора.
Несахарный диабет
- Характеризуется полиурией
- Возникает либо из-за уменьшения синтеза вазопрессина (центральный несахарный диабет), либо из-за нечувствительности к действию вазопрессина на почки (нефрогенный несахарный диабет)
- Центральный несахарный диабет лечат десмопрессином
- Нефрогенный несахарный диабет можно лечить тиазидами
Синдром избыточной выработки вазопрессина[править | править код]
Из-за избыточной выработки вазопрессина происходит задержка жидкости, возникает гипонатриемия и понижается осмоляльность плазмы. Хотя концентрации Na+ в плазме снижены, выделение Na+ в моче может быть нормальным, и у пациента не наблюдается ни отеков, ни обезвоживания. Причины избыточной выработки вазопрессина:
- опухоли, например карцинома мочевого пузыря, простаты или поджелудочной железы;
- легочные инфекции, например туберкулез;
- травма головы.
Терапия избыточной выработки вазопрессина демеклоциклином
Тетрациклин демеклоциклин уменьшает действие вазопрессина на собирательные трубочки, что объясняется подавлением аденилилциклазы. Возникающее снижение синтеза цАМФ уменьшает количество вставок аквапорина-2, что ведет к уменьшению проницаемости мембран для воды.
Почечнокаменная болезнь[править | править код]
Почечнокаменная болезнь (нефролитиаз) развивается, когда плохорастворимые вещества образуют кристаллы в моче, которые соединяются, формируя камни, достаточно большие, чтобы задержаться в мочевой системе. Большие камни в верхних мочевых путях (почечная лоханка и уретра) увеличивают сопротивление потоку мочи, приводя к повышению давления, что мешает клубочковой фильтрации. Подобная длительная или серьезная преграда приводит к функциональному ухудшению работы почки.
Диуретики группы тиазидов предотвращают образование в почках камней из кальция
Большинство почечных камней состоит из оксалата кальция и/или фосфата кальция. Лечение представляет собой удаление камней (хирургически или ультразвуком) и предотвращение дальнейшего их формирования. Тиазиды предотвращают образование камней, т.к. в долгосрочной перспективе они уменьшают выделение Са2+ в моче (см. ранее) у пациентов, камни которых вызваны прежде всего нарушениями в абсорбции Са2+ почками.
Аллопуринол предотвращает мочекислое камнеобразование
Почечнокаменная болезнь также может возникать из-за оседания кристаллов мочевой кислоты (уратов). Лечение аллопуринолом, ингибитором ксантиноксидазы, является предпочтительным, т.к. снижает уровень кислотности мочи и препятствует формированию уратных камней. Камни щавелевой кислоты образуются из-за избытка оксалатов или недостатка пиридоксина (витамина В6) в пище, а также в результате интоксикации антифризами или развития воспалительных желудочно-кишечных заболеваний.
D-пеницилламин предотвращает образование цистиновых камней
Некоторые редкие наследственные заболевания ассоциируются с образованием камней в моче. Цистинурия — аутосомно-рецессивное заболевание, ведущее к нарушению транспорта цистина, орнитина, аргинина в проксимальных почечных канальцах. Цистин менее растворим по сравнению с другими двухосновными аминокислотами, и у гомозиготных людей формируются почечные камни. Формирование камней может быть предотвращено D-пеницилламином, который путем обмена тиола реагирует с цистином, образовывая растворимый пеницилламин-цистеин (см. главу 15).
Гиперурикемия[править | править код]
Гиперурикемия — причина развития подагры, заболевания с отложением в тканях кристаллов урата натрия. Подагру лечат препаратами, которые облегчают выведение с мочой мочевой кислоты (урикозурические средства) благодаря клубочковой фильтрации с выделением в проксимальные канальцы. Однако большая часть мочевой кислоты в жидкости канальцев реабсорбируется контртранспортными системами как в апикальных, так и в базолатеральных мембранах клеток канальцев. Они обменивают ураты на органические или неорганические анионы. Урикозурические препараты ингибируют транспорт уратов через апикальную мембрану. Основные урикозурические препараты пробенецид и сульфинпиразон применяют у пациентов с низким клиренсом мочевой кислоты. Для предотвращения кристаллизации уратов на раннем этапе терапии необходимо высокое потребление жидкости (2 л/сут), а также бикарбоната натрия или калиевой соли лимонной кислоты, чтобы моча имела щелочную реакцию (pH > 6,0). Интересно, что лосартан может увеличить клиренс мочевой кислоты независимо от своей способности блокировать рецепторы ангиотензина II.
ПОБОЧНОЕ ДЕЙСТВИЕ. Урикозурические препараты стараются не применять у пациентов с избытком выработки мочевой кислоты, т.к. можно спровоцировать приступ подагры. Эти препараты нельзя применять при острых приступах подагры.
Пробенецид и сульфинпиразон вызывают желудочно-кишечные расстройства и противопоказаны пациентам с пептической язвой. Пробенецид блокирует почечную секрецию кислых органических веществ, таких как бензилпенициллин, что может пролонгировать их действие и увеличить риск токсичности.
Олигурия[править | править код]
Олигурия — уменьшение объема выделяемой мочи. У врослых в норме количество выводимой мочи составляет приблизительно 1,5 л/сут, а при олигурии объем мочи обычно меньше 400 мл/сут. Если объем выводимой мочи составляет меньше 50 мл/сут, то такое состояние обозначают как анурию.
Олигурия — клинический признак острой почечной недостаточности
Острую почечную недостаточность может вызвать тяжелая гипоперфузия почек, острое повреждение канальцев или непроходимость мочевыводящих путей. Гипоперфузию почек можно устранить, восстановив эффективный объем циркулирующей крови, непроходимость мочевыводящих путей устраняют хирургически. В обеих ситуациях функции почек обычно возвращаются к норме. Если повреждены клетки нефрона, у большинства пациентов олигурия сохраняется в течение 2-4 нед — до выздоровления и постепенного возвращения к нормальному функционированию почек.
Нет препаратов, предотвращающих или купирующих острую почечную недостаточность, но может быть полезен маннитол или фуросемид
Лекарственные средства, предотвращающие или купирующие острую почечную недостаточность, отсутствуют. Тем не менее диуретическая терапия с применением маннитола или фуросемида может оказаться полезной, если в патогенезе почечной дисфункции играет роль внутриканальцевая непроходимость. Эти препараты увеличивают почечный кровоток. Диурез, который они вызывают, помогает поддерживать раскрытое состояние канальцев. Чтобы вызвать диурез при острой почечной недостаточности, дозы фуросемида должны составлять 250 мг/сут (для сравнения — для лечения отеков применяют дозы 20-80 мг).
Острая сердечная недостаточность неблагоприятно влияет на многие органы и системы тела. Для лечения этих нарушений применяют различные средства, например:
- гипотензивные средства;
- антиконвульсанты при судорогах;
- антагонисты Н2 для предотвращения язвы желудка;
- антибактериальные препараты, т.к. во многих случаях развиваются инфекции, которые являются главной причиной летального исхода.
Хроническая почечная недостаточность[править | править код]
Хроническая почечная недостаточность ухудшает работу почек из-за потери функционирующих нефронов, что встречается обычно на поздних стадиях хронических заболеваний почек. Обычные причины:
- тяжелая гипертензия;
- сахарный диабет;
- гломерулонефрит;
- непроходимость мочевыводящих путей.
Лекарственная терапия при хронической почечной недостаточности
Эффективными методами лечения хронической почечной недостаточности являются постоянный диализ и пересадка почек. Для облегчения симптомов применяют:
- петлевые диуретики — для увеличения диуреза и выведения Na+;
- ацетазоламид — для коррекции метаболического алкалоза, ассоциируемого с рвотой при почечной недостаточности;
- гипотензивные средства — для контроля гипертензии, связанной с хронической почечной недостаточностью. Они уменьшают степень снижения почечной функции. Особенно эффективны ингибиторы ангиотензинпревращающего фермента. Большинство пациентов с хронической почечной недостаточностью страдает гипертензией, что может повредить почкам, привести к протеинурии и гиперфильтрации с последующим повреждением клубочков;
- противорвотные средства) — для устранения тошноты и рвоты, испытываемых многими пациентами на поздней стадии почечной недостаточности;
- рекомбинантный человеческий эритропоэтин — для лечения анемий, развивающихся после потери главного источника эритропоэтина из пери-тубулярных клеток в корковом веществе почек. Эритропоэтин стимулирует производство предшественников красных клеток крови в костном мозге;
- гидроксированные формы витамина D (1а-гидроксихолекальциферол и 1,25-дигидроксихолекальциферол) — для поддержания Са2+ в плазме и предотвращения гиперпаратиреоидизма. При хронической почечной недостаточности происходит сбой в механизме активации витамина D из-за нарушения гидроксилирования 25-гидроксихолекальциферола до 1,25-дигидроксихолекальциферола в почках. В результате абсорбция поступающего с пищей Са2+ уменьшается, и уровень Са2+ в плазме снижается. При этом развивается вторичный гиперпаратиреоидизм, который может привести к выведению кальция из костей.
Препараты при почечной недостаточности нужно назначать с большой осторожностью вследствие:
- уменьшения выведения лекарств, прежде всего почками, что может привести к опасному увеличению концентрации препаратов;
- неэффективности некоторых лекарственных средств при ухудшении функции почек;
- вреда здоровью, наносимого почечной недостаточностью и снижающего порог развития неблагоприятных эффектов для некоторых препаратов.
Примеры таких лекарственных средств перечислены в табл. 12.4. Нефротоксичные препараты по возможности не следует применять пациентам с заболеваниями почек, т.к. последствия нефротоксичности будут более серьезными, если функции почек уже ограничены.
Таблица 12.4 Группы лекарственных средств, которые при почечной недостаточности противопоказаны или нужно применять с осторожностью
|
Побочный эффект |
Лекарственные средства |
Примечания |
|
Усиление действия лекарственного средства |
Наркотические анальгетики |
Морфин и его аналоги могут вызвать длительное угнетение ЦНС или необычные неврологические эффекты |
|
Транквилизаторы, нейролептики, седативные препараты |
При почечной недостаточности доза должна быть уменьшена из-за повышенной чувствительности ЦНС | |
|
Уменьшенная реакция на лекарственное средство |
Урикозурические средства |
Пробенецид и сульфинпиразон становятся неэффективными |
|
Антибактериальные препараты |
Нитрофурантоин и налидиксовая кислота не могут достичь эффективной концентрации в моче | |
|
Повышенный риск токсичности |
Сердечные гликозиды |
Снижение выведения дигоксина и повышенный риск аритмии |
|
Калийсберегающие диуретики и калийсодержащие добавки |
Усугубление гипергликемии и острой сердечной недостаточности Калийсодержащие добавки противопоказаны | |
|
Антибактериальные препараты |
Повышенный риск периферической нейропатии при использовании изониазида и нитрофурантоина | |
|
Плохо переносимые побочные эффекты |
Бигуаниды |
Метформин увеличивает риск лактатацидоза |
|
Тетрациклины |
Тетрациклины (кроме доксициклина и миноциклина) подавляют синтез белков и вызывают катаболический эффект, что ведет к повышенному метаболизму аминокислот. Это может усугубить почечную недостаточность |
Читайте также:Диета при хронической почечной недостаточности
Гломерулонефрит[править | править код]
Термин «гломерулонефрит» объединяет целый ряд почечных заболеваний, характеризующихся воспалительными изменениями в клубочках. Как правило, пациенты с гломерулонефритом имеют гематурию, протеинурию и уменьшенную почечную функцию, связанную с задержкой жидкости, гипертензией и отеками. Гломерулонефрит встречается как первичная болезнь почек или возникает из-за системного заболевания, например системной красной волчанки. Причины первичного гломерулонефрита не всегда ясны, но могут быть связаны с бактериальными или вирусными инфекциями.
Лекарственная терапия гломерулонефрита
Лекарственное лечение гломерулонефрита подобно лечению нефротического синдрома (см. ранее). Не существует терапии, эффективной при всех формах гломерулонефрита, но у некоторых пациентов может наступить сохранение или улучшение функции почек при использовании:
- гипотензивных средств для контроля за артериальным давлением. Ингибиторы АПФ (каптоприл и др.) — средства выбора, т.к. они уменьшают внутриклубочковое давление и протеинурию;
- тиазидных или петлевых диуретиков для уменьшения задержки жидкости;
- иммунодепрессантов — глюкокортикостероидов или их комбинации с цитостатическими препаратами типа циклофосфамида.
Читайте также: Диета при гломерулонефрите
Диализ и лекарственная терапия[править | править код]
Диализ может осложнить лекарственную терапию
При диализе в специальном устройстве (аппарат «искусственная почка») отделяют полупроницаемыми мембранами легко диффундирующие растворы от менее легко диффундирующих. Диализ применяют на терминальной стадии заболеваний почек для удаления азотистых веществ и избытка воды. Кроме того, диализ полезен при лечении передозировок и отравлений.
Существует два вида диализа:
- гемодиализ — кровь проходит через систему с раствором для диализа, отделенным от крови полупроницаемой мембраной;
- перитонеальный диализ — раствор для диализа подают в брюшную полость. В этом случае брюшина действует как полупроницаемая мембрана.
В обоих методах растворы распространяются из крови в жидкость для диализа.
Диализ усложняет лекарственную терапию, т.к. препарат выводится из крови не только собственными механизмами выделения, но и диализом. Если диализный клиренс значительно влияет на выведение препарата, необходимо вводить дополнительные дозы препарата.
Выведение лекарств диализом зависит от техники диализа, фракций препарата, находящихся в крови, и размера молекул Анализируемого вещества. Гемодиализ выводит препараты более эффективно, чем перитонеальный диализ. Соответственно, при лекарственной передозировке или отравлениях выбирают гемодиализ. Только свободный, несвязанный препарат формирует градиент концентрации, определяющий диффузию веществ из крови в жидкость для диализа. При высокой степени связывания лекарственных веществ белками плазмы очищение диализом ограничено. Большинство молекул лекарственных веществ имеют достаточно малый размер для диффузии через искусственные или эндогенные тканевые мембраны.
Нефротоксичные препараты[править | править код]
Центральная роль почек в выведении лекарств и метаболитов делает их восприимчивыми к неблагоприятным эффектам препаратов. Почечная ткань подвергается воздействию препаратов как через кровь, так и через почечные канальцы. Концентрации веществ в канальцах могут быть намного выше, чем в крови и, следовательно, более токсичными. Различные нефротоксичные вещества оказывают действие на различные части нефронов. Это следует из особенностей транспорта, клеточной энергетики, механизмов биоактивации или детоксикации. Причины селективной почечной токсичности некоторых лекарств еще только предстоит изучить. Участки действия некоторых нефротоксичных лекарств показаны на рис. 12.12.
Некоторые антибактериальные препараты могут быть нефротоксичными[править | править код]
Нефротоксичны аминогликозиды, амфотерицин В и некоторые цефалоспорины первого поколения. Порядок этих лекарств по токсичности таков: гентамицин, тобрамицин, амикацин и нетилмицин.
Аминогликозиды важны при лечении тяжелых грамотрицательных инфекций, но у 10-15% пациентов развивается острая почечная недостаточность. Первичный участок поражения — проксимальные канальцы.
Системное антимикотическое лекарственное средство амфотерицин В нефротоксичен у 80% пациентов. Этот препарат вызывает сужение сосудов почек, и, хотя повреждаются несколько областей нефронов, первичный участок токсичности — дистальные канальцы.
Некоторые цефалоспорины первого поколения (цефалоридин и цефалотин) потенциально нефротоксичны, но не настолько, как аминогликозиды и амфотерицин В.
Противоопухолевые препараты[править | править код]
Противоопухолевые алкилирующие агенты и соединения платины могут вызывать повреждения почек
Нефротоксичность алкилирующих агентов типична. Циклофосфамид и ифосфамид вызывают образование акролеина — нефротоксичного вещества, которое приводит к развитию геморрагического цистита. Это можно предотвратить единовременным приемом 2-меркаптоэтан-сульфоната, который реагирует с акролеином, переводя его в мочевых путях в нетоксичное соединение.
Цисплатин и в меньшей степени карбоплатин также нефротоксичны. Наносимый цисплатином вред главным образом затрагивает прямую часть проксимальных канальцев. Чтобы минимизировать вред, обычно пациента перед введением препарата гидратируют вливанием 1-2 л физиологического раствора.
Разрушение клеток противоопухолевыми лекарствами высвобождает большое количество пуринов. Катаболизм пуринов приводит к чрезмерному образованию и выделению уратов и увеличенному риску формирования камней в почках и гиперуремической подагры.
Иммунодепрессанты[править | править код]
Циклоспорин и такролимус могут нанести вред почкам
Нефропатия из-за циклоспорина и такролимуса связана с неблагоприятным влиянием на сосуды почек. Циклоспорин обычно вызывает острое обратимое ухудшение почечной функции на ранних этапах его применения. Это связано с сужением центростремительных артериолярных сосудов, что полностью устраняется дофамином и нифедипином. Встречается также хроническая нефротоксичность, она может возникать вследствие склерозных повреждений центростремительных артериол клубочков.
Анальгетики[править | править код]
Ацетаминофен и НПВС могут неблагоприятно влиять на почки
Острая почечная недостаточность в результате острого некроза канальцев встречается приблизительно в 2% случаев передозировки ацетаминофена. Почечная дисфункция обычно сопровождается тяжелой печеночной недостаточностью, но в некоторых случаях встречается острая почечная недостаточность без печеночной недостаточности. Острая почечная олигурическая недостаточность наступает через несколько дней после приема ацетаминофена внутрь.
Хроническая нефропатия, вызванная НПВС, характеризуется интерстициальным нефритом и папиллярным некрозом почек. Повреждения почек возникают из-за длительного приема НПВС и редко встречаются у пациентов моложе 30 лет. В основном страдают женщины в возрасте 40-60 лет. Потеря папиллярной ткани может привести к вторичному повреждению нефронов и в конечном счете к нарушению функции почек.
Литий может быть нефротоксичен
У некоторых пациентов, у которых при лечении аффективных расстройств применяли препараты лития, развивается нефрогенный несахарный диабет, обычно полностью проходящий после отмены препарата. Механизмом нефротоксичности является уменьшение активации аденилилциклазы. Для полного излечения вызванного литием несахарного диабета применяют амилорид, ингибирующий реабсорбцию лития через Nа+-каналы в собирательных трубочках.
Некоторые лекарства вызывают острый интерстициальный нефрит
Многие лекарства могут привести к острому ухудшению почечной функции, вызывая воспаление почечных интерстициальных тканей, возможно, из-за их гиперчувствительности. Список таких препаратов включает:
- сульфонамиды (включая ко-тримоксазол);
- нестероидные противовоспалительные средства;
- диуретики (тиазиды и фуросемид);
- аллопуринол;
- циметидин.
У пациентов часто встречается сопутствующая лихорадка, кожная сыпь и гематурия.
Читайте также[править | править код]
- Анатомия почки
- Почки как орган выделения
- Функции почек
- Кислотно-щелочной баланс
- Клубочковая фильтрация и клиренс
- Транспорт в нефроне
- Реабсорбция в почках
- Гомеостаз жидкостей организма
- Почечная недостаточность и спорт (тренировки с одной почкой)
- Тиазидные диуретики
- Тиазидоподобные диуретики
- Ингибиторы карбоангидразы
- Петлевые диуретики
- Осмотические диуретики
- Растительные диуретики
- Диуретики в спорте
Литература[править | править код]
- Carter BL, Ernst ME, Cohen JD. Hydrochlorothiazide versus chlorthalidone: evidence supporting their interchangeability. Hypertension 2004; 43: 4-9. [Nuanced discussion of the clinical pharmacology and therapeutics of two important diuretics.]
- Casas JP, Chua W, Loukogeorgakis S, Vallance P, Smeeth L, Hingorani AD, MacAllister RJ. Effect of inhibitors of the renin-angiotensin system and other antihypertensive drugs on renal outcomes: systematic review and meta-analysis. Lancet 2005; 366: 2026-2033. [An attempt to provide a clear view of the interactions of antihypertensive drugs on kidney functioning.]
- Cretkovic RS, Plasker CL. Desmopressin. Drugs 2005; 65: 99-107. [Pharmacokinetics and dynamics of desmopressin.]
- Kote CJ. Principles of Renal Physiology, 4th edn. Dordrecht, The Netherlands: Kluwer Academic; 2000. [A clear and concise introduction to renal physiology.]
- Pattison JM. A colour handbook of renal medicine. London: Manson Pub., 2004.
Subramanian S, Ziedalski TM. Oliguria, volume overload, Na+ balance, and diuretics. Crit Care Clin 2005; 21:291-303. [A basic primer for understanding sodium and water balance and its adjustment.]
- Wilson WC, Aronson S. Oliguria. A sign of renal success or impending renal failure? Anesthesiol Clin N Am 2001; 19: 841-883.