Нингидриновая реакция на определение аминокислот и белка — различия между версиями
Admin (обсуждение | вклад) |
Admin (обсуждение | вклад) |
||
| (не показано 7 промежуточных версий 1 участника) | |||
| Строка 1: | Строка 1: | ||
| + | == Спектрофотометрическое исследование продуктов нингидриновой реакции == | ||
| + | Разработка точных, доступных методов анализа а-[[Аминокислоты|аминокислот]] является одной из актуальных задач современной фармации, в данной статье описан простой и доступный способ определения аминокислот и [[протеин]]а в различных продуктах, включая [[Биологически активные добавки|биологически-активные добавки]] и [[спортивное питание]]. | ||
| + | |||
| + | В настоящее время существует ряд методов количественного определения а-аминокислот в лекарственном растительном сырье, в лекарственных препаратах и биологических жидкостях [1—31]. Однако, несмотря на высокую точность, их применение ограничено длительностью приготовления рабочих растворов (потенциометрическое титрование в неводной среде), дороговизной оборудования (ГЖХ, ВЭЖХ) [4, 6,27,28, 30]. | ||
| + | |||
| + | Для анализа а-аминокислот также широко используют методы, основанные на реакции с нингидрином [1,3, 8,9, 11-20,23, 29]. | ||
| + | |||
| + | Khan А. с соавторами изучили механизм нингидриновой реакции [29]: | ||
| + | [[Image:Ningidrid.jpg|250px|thumb|right|Нингидриновая реакция]] | ||
| + | На первой стадии реакции о-аминокислот с нингидрином (I) образуются углерода диоксид, альдегид и устойчивое промежуточное соединение - 2-аминоиндандион (II), участвующий в двух параллельных реакциях. В одной из них он реагирует с нингидрином до образования 2-гидроксииндандиона (III) и 2-иминоиндандиона (IV), которые, конденсируясь между собой, формируют дикетогидринденкетогидринамин (V). Во второй реакции 2-аминоиндандион в кислой среде подвергается гидролизу до аммиака и 2-гидроксииндандиона, последний, взаимодействуя с нингидрином, образует гидриндантин (VI). | ||
| + | |||
| + | Установлено, что характерная для большинства а-аминокислот пурпурная окраска(окраска Румана) обусловлена образованием дикетогидринденкетогидринамина (V), а также продукта параллельной реакции - гидриндантина (VI), который мало растворим в воде и растворим в органических растворителях - диметилсульфоксиде (ДМСО) и метилцелозольве. Поэтому, с целью повышения чувствительности реакции, по предположению авторов, наиболее рационально использовать растворы нингидрина в указанных растворителях. Максимальные значения оптической плотности продуктов реакции (при длине волны 575 нм) наблюдаются при соблюдении следующих условий ее проведения: температура реакционной смеси - 95 °С, pH — 5-6. Кроме того, реакцию необходимо проводить без доступа кислорода, в атмосфере азота. | ||
| + | |||
| + | Для детектирования продукта нингидриновой реакции используют спектрофотометры, флуориметры. | ||
| + | |||
| + | Широкое распространение в анализе аминокислот получили аминокислотные анализаторы [1,9,11,13—15, 17]. Данный метод основан на разделении аминокислот с помощью ионообменной хроматографии с последующим фотоколориметрическим определением продуктов реакции аминокислот с нингидрином. Применение аминокислотных анализаторов позволяет разделить исследуемый образец на отдельные компоненты и определить их количество быстро и с высокой точностью. Главным недостатком данного метода анализа является высокая стоимость оборудования, что делает его недоступным для большинства лабораторий. | ||
| + | |||
| + | Более доступными и простыми являются фотоколориметрические и спектрофотометрические методы анализа о-аминокислот, основанные на их взаимодействии с нингидрином. Так, В.А. Храмовым модифицирован метод определения диаминокислот по Чинарду [12]. Метод основан на образовании красно-коричневых продуктов взаимодействия диаминокислот с нингидрином с последующим фотоколориметрическим определением при длине волны 490 нм. Метод является специфичным: нейтральные аминокислоты, а также амины и диамины при pH 1 с нингидрином окрашенных продуктов не образуют. Несмотря на доступность и простоту данный метод не является универсальным для всех а-аминокислот и позволяет определить лишь диаминокислоты, из которых наибольшее практическое значение имеет незаменимая аминокислота лизин. Кроме того, этим методом можно определить пролин. | ||
| + | |||
| + | Разработана точная методика количественного определения кислоты аспарагиновой в лекарственном препарате «[[Аспаркам]]», основанная на ее взаимодействии с 1 % этаноловым раствором нингидрина и последующим определением оптической плотности продукта реакции при длине волны 568 нм. Метод отличается хорошей воспроизводимостью, относительная ошибка среднего результата составила ±2,25 % [19]. Кроме того, предложен спектрофотометрический метод анализа суммы аминокислот различных видов пыльцы, основанный на взаимодействии с 2 % этаноловым раствором нингидрина [11]. | ||
| + | |||
| + | С этих позиций представляет интерес изучение спектральных характеристик продуктов нингидриновой реакции 20-ти наиболее важных в биологическом отношении а-аминокислот, оптимизация условий ее проведения с целью разработки точного и доступного метода количественного определения а-аминокислот в растительном сырье, субстанциях и суммарных лекарственных препаратах. | ||
| + | |||
| + | == Исследование спектральных характеристик продуктов реакции а-аминокислот с 0,2 % раствором нингидрина в ацетоне == | ||
| + | |||
| + | В соответствии с ГФ XI наиболее часто в хроматографических методах анализа а-аминокислот используют 0,2 % раствор нингидрина в ацетоне [3, 8]. На этом основании мы изучили спектры продуктов реакции для 20-ти а-аминокислот с ОД % раствором нингидрина в ацетоне с целью создания нового метода количественного анализа аминокислот в различных объектах. | ||
| + | |||
| + | Нингидриновую реакцию проводили по методике, указанной в ФСП на кислоту глутаминовую в разделе «подлинность»: к 1 мл 2 % раствора а-аминокислоты прибавляют 1 мл свежеприготовленного 0,2 % раствора нингидрина в ацетоне и нагревают до появления сине-фиолетовой окраски [10]. Цистеин и тирозин, вследствие их низкой растворимости в воде, использовали в виде менее концентрированных 0,04 % растворов. После полного охлаждения продукты нингидриновой реакции каждой из 20-ти а-аминокислот разбавляли водой в различных соотношениях до получения значений оптической плотности максимумов поглощения от 0,4 до 1,0. | ||
| + | |||
| + | Исследование спектров поглощения в видимой области показало наличие двух максимумов в диапазонах длин волн 399-405 и 560-570 нм. Данная закономерность наблюдается для 19-ти из 20-ти а-аминокислот (рис. 1-4). Исключение составляет пролин, продукт реакции которого с нингидрином имеет один максимум поглощения в видимой области — при длине волны 416 нм, что объясняется отсутствием первичной аминогруппы в структуре данной аминокислоты. | ||
| + | [[Image:Ningidr1.jpg|250px|thumb|right|Рис 1. Видимая область спектра продуктов взаимодействия а-аминокислот с 0,2 % раствором нингидрина в ацетоне]] | ||
| + | |||
| + | [[Image:Ningidr2.jpg|250px|thumb|right|Рис 2. Видимая область спектра продуктов взаимодействия а-аминокислот с 0,2 % раствором нингидрина в ацетоне]] | ||
| + | |||
| + | [[Image:Ningidr3.jpg|250px|thumb|right|Рис 3. Видимая область спектра продуктов взаимодействия а-аминокислот с 0,2 % раствором нингидрина в ацетоне]] | ||
| + | |||
| + | [[Image:Ningidr4.jpg|250px|thumb|right|Рис 4. Видимая область спектра продуктов взаимодействия а-аминокислот с ОД % раствором нингидрина в ацетоне]] | ||
| + | |||
| + | Исследована также УФ-область спектра продуктов реакции 20-ти а-аминокислот с 0,2 % раствором нингидрина в ацетоне и установлено, что все они также имеют два максимума поглощения в диапазонах длин волн 220-237 и 254-260 нм (рис. 5-8). Исключение составляет продукт реакции с пролином, максимумы поглощения которого составляют 299 и 343 нм. | ||
| + | [[Image:Ningidr5.jpg|250px|thumb|right|Рис 5. УФ-область спектра продуктов взаимодействия а-аминокислот с 0,2 % раствором нингидрина в ацетоне]] | ||
| + | |||
| + | [[Image:Ningidr6.jpg|250px|thumb|right|Рис 6. УФ-область спектра продуктов взаимодействия а аминокислот с 0,2 % раствором нингидрина в ацетоне]] | ||
| + | |||
| + | [[Image:Ningidr7.jpg|250px|thumb|right|Рис 7. УФ-область спектра продуктов взаимодействия а-аминокислот с 0,2 % раствором нингидрина в ацетоне]] | ||
| + | |||
| + | [[Image:Ningidr8.jpg|250px|thumb|right|Рис 8. УФ-область спектра продуктов взаимодействия а-аминокислот с 0,2 % раствором нингидрина в ацетоне]] | ||
| + | |||
| + | Максимумы поглощения (в видимой и УФ-области) продуктов взаимодействия 20-ти а-аминокислот с 0,2 % раствором нингидрина в ацетоне представлены в таблице 1. | ||
| + | |||
| + | '''Таблица 1. Характеристика спектров поглощения продуктов реакции а-аминокислот с 0,2 % раствором нингидрина в ацетоне.''' | ||
| + | |||
| + | <table cellpadding="7" border="1"> | ||
| + | <tr><td> | ||
| + | <p>№</p></td><td> | ||
| + | <p>а-Аминокислота</p></td><td colspan="2"> | ||
| + | <p>Максимумы поглощения</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>п/п</p></td><td> | ||
| + | <p></p></td><td> | ||
| + | <p>УФ-область</p></td><td> | ||
| + | <p>Видимая область</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>[[Бета-аланин|Аланин]]</p></td><td> | ||
| + | <p>231,251</p></td><td> | ||
| + | <p>401, 567</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>2</p></td><td> | ||
| + | <p>[[Аргинин]]</p></td><td> | ||
| + | <p>232,256</p></td><td> | ||
| + | <p>400, 561</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>3</p></td><td> | ||
| + | <p>Аспарагин</p></td><td> | ||
| + | <p>231,256</p></td><td> | ||
| + | <p>400*568</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>4</p></td><td> | ||
| + | <p>[[D-аспарагиновая кислота|Аспарагиновая кислота]]</p></td><td> | ||
| + | <p>230, 256</p></td><td> | ||
| + | <p>400,564</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>5</p></td><td> | ||
| + | <p>Валин</p></td><td> | ||
| + | <p>230, 257</p></td><td> | ||
| + | <p>400, 560</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>6</p></td><td> | ||
| + | <p>[[Гистидин]]</p></td><td> | ||
| + | <p>229, 255</p></td><td> | ||
| + | <p>401, 568</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>7</p></td><td> | ||
| + | <p>[[Глицин]]</p></td><td> | ||
| + | <p>231,256</p></td><td> | ||
| + | <p>401,568</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>8</p></td><td> | ||
| + | <p>[[Глутамин]]</p></td><td> | ||
| + | <p>230, 256</p></td><td> | ||
| + | <p>401,566</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>9</p></td><td> | ||
| + | <p>Глутаминовая кислота</p></td><td> | ||
| + | <p>230, 256</p></td><td> | ||
| + | <p>400, 568</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>10</p></td><td> | ||
| + | <p>Изолейцин</p></td><td> | ||
| + | <p>230, 257</p></td><td> | ||
| + | <p>399, 565</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>11</p></td><td> | ||
| + | <p>Лейцин</p></td><td> | ||
| + | <p>237, 258</p></td><td> | ||
| + | <p>400, 565</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>12</p></td><td> | ||
| + | <p>Лизин</p></td><td> | ||
| + | <p>230, 255</p></td><td> | ||
| + | <p>400, 565</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>13</p></td><td> | ||
| + | <p>[[Метионин]]</p></td><td> | ||
| + | <p>230, 254</p></td><td> | ||
| + | <p>401,566</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>14</p></td><td> | ||
| + | <p>Серин</p></td><td> | ||
| + | <p>230, 256</p></td><td> | ||
| + | <p>401,567</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>15</p></td><td> | ||
| + | <p>[[Треонин]]</p></td><td> | ||
| + | <p>230, 256</p></td><td> | ||
| + | <p>402,567</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>16</p></td><td> | ||
| + | <p>[[Тирозин]]</p></td><td> | ||
| + | <p>228, 258</p></td><td> | ||
| + | <p>400, 567</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>17</p></td><td> | ||
| + | <p>[[Триптофан]]</p></td><td> | ||
| + | <p>229,263</p></td><td> | ||
| + | <p>401,568</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>18</p></td><td> | ||
| + | <p>[[Цистеин]]</p></td><td> | ||
| + | <p>230, 257</p></td><td> | ||
| + | <p>401,566</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>19</p></td><td> | ||
| + | <p>[[Фенилаланин]]</p></td><td> | ||
| + | <p>230, 255</p></td><td> | ||
| + | <p>401, 564</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>20</p></td><td> | ||
| + | <p>Пролин</p></td><td> | ||
| + | <p>299, 343</p></td><td> | ||
| + | <p>416</p></td></tr> | ||
| + | </table> | ||
| + | |||
| + | Из данных таблицы 1 видно, что для большинства а аминокислот характерны четыре максимума поглощения, два из которых находятся в УФ-области, в интервале длин волн 228-237 и 251-263 нм, и два - в видимой области, в диапазоне 399-402 и 560-568 нм. | ||
| + | |||
| + | == Оптимизация условий реакции а-аминокислот с 0,2 % раствором нингидрина в ацетоне == | ||
| + | |||
| + | Как установлено нами выше, большинство продуктов реакции а-аминокислот с раствором нингидрина в ацетоне характеризуются единым максимумом поглощения при длине волны 400 нм, что обуславливает целесообразность использования данной длины волны в качестве аналитической. | ||
| + | |||
| + | Нами установлено, что продукты реакции, проведенной по методике, указанной в разделе 1.1, характеризуются низкой стабильностью во времени (для большинства а-аминокислот значение оптической плотности в диапазоне длин волн 399-400 нм и интервале 1-2 ч после начала реакции снижается более чем на 15 %). Поэтому нами изучены оптимальные условия реакции в зависимости от соотношения между ее компонентами (навески и объема раствора о-аминокислоты, объема ОД % раствора нингидрина в ацетоне), продолжительности и температурного режима реакции. Для анализа мы использовали фенилаланин. | ||
| + | |||
| + | С целью изучения влияния количественных соотношений между растворами фенилаланина и нингидрина на стабильность продукта реакции нами проведена серия экспериментов (табл. 2). Реакцию проводили при температуре 100 °С в течение 10 мин (до образования темно-фиолетовой окраски). Продукты после полного охлаждения разбавляли водой и измеряли значение оптической плотности при длине волны 400 нм. О стабильности продуктов реакции мы судили по величине снижения оптической плотности, % за период 1-2 ч после начала реакции. | ||
| + | |||
| + | '''Таблица 2. Оптимизация количественных соотношений компонентов реакции''' | ||
| + | |||
| + | <table cellpadding="7" border="1"> | ||
| + | <tr><td rowspan="2"> | ||
| + | <p>№ п/п</p></td><td colspan="3"> | ||
| + | <p>Количественные соотношения между компонентами реакции</p></td><td rowspan="2"> | ||
| + | <p>Разведение продукта реакции водой</p></td><td colspan="2"> | ||
| + | <p>Оптическая плотность продукта при λ=400 нм</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>Навеска фенилала нина, г</p></td><td> | ||
| + | <p>Объем раствора фенилалани на, мл</p></td><td> | ||
| + | <p>Объем 0,2 % раствора нингидрина в ацетоне, мл</p></td><td> | ||
| + | <p>Через 1 ч после начала реакции</p></td><td> | ||
| + | <p>Снижение значения за период 1-2 ч после начала</p> | ||
| + | <p>реакции, %</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>2</p></td><td> | ||
| + | <p>3</p></td><td> | ||
| + | <p>4</p></td><td> | ||
| + | <p>5</p></td><td> | ||
| + | <p>6</p></td><td> | ||
| + | <p>7</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>0,02</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>1:6</p></td><td> | ||
| + | <p>0,72747</p></td><td> | ||
| + | <p>15</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>2</p></td><td> | ||
| + | <p>0,005</p></td><td> | ||
| + | <p>2,75</p></td><td> | ||
| + | <p>0,25</p></td><td> | ||
| + | <p>-</p></td><td> | ||
| + | <p>0,06456</p></td><td> | ||
| + | <p>-</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>3</p></td><td> | ||
| + | <p>0,005</p></td><td> | ||
| + | <p>2,5</p></td><td> | ||
| + | <p>0,5</p></td><td> | ||
| + | <p>1:3</p></td><td> | ||
| + | <p>0,60825</p></td><td> | ||
| + | <p>6,5</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>4</p></td><td> | ||
| + | <p>0,005</p></td><td> | ||
| + | <p>2,25</p></td><td> | ||
| + | <p>0,75</p></td><td> | ||
| + | <p>1:4</p></td><td> | ||
| + | <p>0,75645</p></td><td> | ||
| + | <p>12,5</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>5</p></td><td> | ||
| + | <p>0,005</p></td><td> | ||
| + | <p>2</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>1:5</p></td><td> | ||
| + | <p>0,75235</p></td><td> | ||
| + | <p>13,5</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>6</p></td><td> | ||
| + | <p>0,005</p></td><td> | ||
| + | <p>1,5</p></td><td> | ||
| + | <p>1,5</p></td><td> | ||
| + | <p>1:10</p></td><td> | ||
| + | <p>0,76256</p></td><td> | ||
| + | <p>14</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>7</p></td><td> | ||
| + | <p>0,005</p></td><td> | ||
| + | <p>2,25</p></td><td> | ||
| + | <p>0,5</p></td><td> | ||
| + | <p>1:3</p></td><td> | ||
| + | <p>0,57195</p></td><td> | ||
| + | <p>И</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>8</p></td><td> | ||
| + | <p>0,005</p></td><td> | ||
| + | <p>2,75</p></td><td> | ||
| + | <p>0,5</p></td><td> | ||
| + | <p>1:3</p></td><td> | ||
| + | <p>041382</p></td><td> | ||
| + | <p>9,5</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>9</p></td><td> | ||
| + | <p>0,004</p></td><td> | ||
| + | <p>2,5</p></td><td> | ||
| + | <p>0,5</p></td><td> | ||
| + | <p>1:3</p></td><td> | ||
| + | <p>0,51826</p></td><td> | ||
| + | <p>9</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>10</p></td><td> | ||
| + | <p>0,006</p></td><td> | ||
| + | <p>2,5</p></td><td> | ||
| + | <p>0,5</p></td><td> | ||
| + | <p>1:3</p></td><td> | ||
| + | <p>0,58310</p></td><td> | ||
| + | <p>10</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>11</p></td><td> | ||
| + | <p>0,005</p></td><td> | ||
| + | <p>2,5</p></td><td> | ||
| + | <p>0,75</p></td><td> | ||
| + | <p>1:3</p></td><td> | ||
| + | <p>0,59274</p></td><td> | ||
| + | <p>10,5</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>12</p></td><td> | ||
| + | <p>0,005</p></td><td> | ||
| + | <p>2,5</p></td><td> | ||
| + | <p>0,25</p></td><td> | ||
| + | <p>1:2</p></td><td> | ||
| + | <p>0,63057</p></td><td> | ||
| + | <p>8,5</p></td></tr> | ||
| + | </table> | ||
| + | |||
| + | Здесь и далее - показывает соотношения между объемами продукта реакции до и после их разведения водой (мл). | ||
| + | |||
| + | На основании полученных данных нами установлены оптимальные соотношения между компонентами реакции: 2,5 мл 0,2 % раствора о аминокислоты и 0,5 мл 0,2% свежеприготовленного раствора нингидрина в ацетоне. При соблюдении данных условий образуется наиболее стабильный продукт, характеризующийся максимальным значением оптической плотности при длине волны 400 нм, | ||
| + | |||
| + | Мы изучили также влияние продолжительности реакции во времени на величину и стабильность значения оптической плотности продукта (табл. 3). Реакцию проводили с учетом оптимизированных выше соотношений между ее компонентами при температуре 100 °С. | ||
| + | |||
| + | '''Таблица 3 Оптимизация продолжительности реакции во времени''' | ||
| + | |||
| + | <table cellpadding="7" border="1"> | ||
| + | <tr><td rowspan="2"> | ||
| + | <p>№ п/п</p></td><td rowspan="2"> | ||
| + | <p>Продолжительность проведения реакции, мин</p></td><td rowspan="2"> | ||
| + | <p>Разведение продукта реакции водой</p></td><td colspan="2"> | ||
| + | <p>Оптическая плотность продукта при λ=400 нм</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>Через 1 ч после начала реакции</p></td><td> | ||
| + | <p>Снижение значения за период 1-2 ч после начала реакции, %</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>/</p></td><td> | ||
| + | <p>2</p></td><td> | ||
| + | <p>3</p></td><td> | ||
| + | <p>4</p></td><td> | ||
| + | <p>5</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>2</p></td><td> | ||
| + | <p>1:2</p></td><td> | ||
| + | <p>0,32569</p></td><td> | ||
| + | <p>10</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>2</p></td><td> | ||
| + | <p>4</p></td><td> | ||
| + | <p>1:2</p></td><td> | ||
| + | <p>0,54934</p></td><td> | ||
| + | <p>9</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>3</p></td><td> | ||
| + | <p>6</p></td><td> | ||
| + | <p>1:3</p></td><td> | ||
| + | <p>0,48458</p></td><td> | ||
| + | <p>8,5</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>4</p></td><td> | ||
| + | <p>8</p></td><td> | ||
| + | <p>1:3</p></td><td> | ||
| + | <p>0,56588</p></td><td> | ||
| + | <p>8</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>5</p></td><td> | ||
| + | <p>10</p></td><td> | ||
| + | <p>1:3</p></td><td> | ||
| + | <p>0,60825</p></td><td> | ||
| + | <p>6,5</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>6</p></td><td> | ||
| + | <p>12</p></td><td> | ||
| + | <p>1:3</p></td><td> | ||
| + | <p>0,61945</p></td><td> | ||
| + | <p>6</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>7</p></td><td> | ||
| + | <p>14</p></td><td> | ||
| + | <p>1:3</p></td><td> | ||
| + | <p>0,62521</p></td><td> | ||
| + | <p>6</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>8</p></td><td> | ||
| + | <p>15</p></td><td> | ||
| + | <p>1:3</p></td><td> | ||
| + | <p>0,64187</p></td><td> | ||
| + | <p>4</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>9</p></td><td> | ||
| + | <p>16</p></td><td> | ||
| + | <p>1:3</p></td><td> | ||
| + | <p>0,62891</p></td><td> | ||
| + | <p>7</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>10</p></td><td> | ||
| + | <p>18</p></td><td> | ||
| + | <p>1:3</p></td><td> | ||
| + | <p>0,59476</p></td><td> | ||
| + | <p>8</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>11</p></td><td> | ||
| + | <p>20</p></td><td> | ||
| + | <p>1:3</p></td><td> | ||
| + | <p>0,54398</p></td><td> | ||
| + | <p>10</p></td></tr> | ||
| + | </table> | ||
| + | |||
| + | Анализ данных таблицы 3 показывает, что наиболее стабильный продукт с максимальным значением оптической плотности образуется при проведении реакции в течение 15 мин. Более длительное нагревание приводит к разложению продуктов реакции со значительным снижением оптической плотности. При нагревании реакционной смеси менее 15 мин величина оптической плотности вначале незначительно возрастает, а затем наблюдается резкое снижение ее значения. | ||
| + | |||
| + | Далее мы изучили влияние температурного режима реакции на стабильность значения оптической плотности продукта при длине волны 400 нм. Реакцию проводили в диапазоне температур от 50 до 110 в течение 15 мин (табл. 4). | ||
| + | |||
| + | '''Таблица 4 Оптимизация температурного режима реакции''' | ||
| + | |||
| + | <table cellpadding="7" border="1"> | ||
| + | <tr><td rowspan="2"> | ||
| + | <p>№ п/п</p></td><td rowspan="2"> | ||
| + | <p>Температурный режим реакции, °С</p></td><td rowspan="2"> | ||
| + | <p>Разведение продукта реакции водой</p></td><td colspan="2"> | ||
| + | <p>Оптическая плотность продукта при λ=400 нм</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>Через 1 ч после начала реакции</p></td><td> | ||
| + | <p>Снижение значения за период 1-2 ч после начала реакции, %</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>50</p></td><td> | ||
| + | <p>-</p></td><td> | ||
| + | <p>0,0706</p></td><td> | ||
| + | <p>- .</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>2</p></td><td> | ||
| + | <p>60</p></td><td> | ||
| + | <p>-</p></td><td> | ||
| + | <p>0,11835</p></td><td> | ||
| + | <p>-</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>3</p></td><td> | ||
| + | <p>70</p></td><td> | ||
| + | <p>-</p></td><td> | ||
| + | <p>0,25843</p></td><td> | ||
| + | <p>12</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>4</p></td><td> | ||
| + | <p>S0</p></td><td> | ||
| + | <p>1:2</p></td><td> | ||
| + | <p>0,38956</p></td><td> | ||
| + | <p>8</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>5</p></td><td> | ||
| + | <p>90</p></td><td> | ||
| + | <p>1:3</p></td><td> | ||
| + | <p>0,48453</p></td><td> | ||
| + | <p>6</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>6</p></td><td> | ||
| + | <p>100</p></td><td> | ||
| + | <p>1:3</p></td><td> | ||
| + | <p>0,64187</p></td><td> | ||
| + | <p>4</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>7</p></td><td> | ||
| + | <p>110</p></td><td> | ||
| + | <p>1:3</p></td><td> | ||
| + | <p>0,55917</p></td><td> | ||
| + | <p>10</p></td></tr> | ||
| + | </table> | ||
| + | |||
| + | Мы установили, что при температуре ниже 70 °С реакционная смесь характеризуется отсутствием максимумов поглощения в диапазонах длин волн 399-402 и 560-570 нм а также характерной сине-фиолетовой окраски. Наиболее высокие и стабильные значения оптической плотности наблюдаются при проведении реакции с температурным режимом 100 °С (за период 1-2 ч после начала реакции значение оптической плотности при длине волны 400 нм снизилось на 4 %). Проведение реакции выше 100 °С нецелесообразно т.к. образующийся продукт нестабилен во времени. | ||
| + | |||
| + | Таким образом, нами установлены оптимальные условия проведения реакции а-аминокислот с 0,2 % раствором нингидрина в ацетоне и на этом основании предлагается следующая методика анализа: к 2,5 мл 0,2 % раствора а-аминокислоты добавляют 0,5 мл 0,2 % раствора нингидрина в ацетоне и нагревают при температуре 100 °С в течение 15 мин (для лизина продолжительность реакции составляет 3-5 мин, т.к. более длительное нагревание приводит к разложению продукта реакции). После полного охлаждения продукт реакции разбавляют водой очищенной и спустя 1 ч после начала реакции определяют значение оптической плотности в диапазонах длин волн 399-402 нм на спектрофотометре в кюветах с толщиной поглощающего слоя 10 мм. | ||
| + | |||
| + | Данные условия проведения реакции мы использовали для большинства а-аминокислот, однако цистеин и тирозин вследствие их низкой растворимости в воде использовали в концентрации 0,04 % растворов по 2,5 мл. | ||
| + | |||
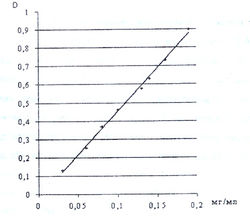
| + | С целью выявления подчинения закону светопоглощения продуктов реакции а-аминокислот с 0,2 % раствором нингидрина в ацетоне при длине волны 400 нм нами исследована зависимость светопоглощения от концентрации а-аминокислоты (рис. 9). | ||
| + | [[Image:Ningidr9.jpg|250px|thumb|right|Рис 9. Калибровочный график продукта реакции метионина]] | ||
| + | |||
| + | На рис. 9 приведен калибровочный график, который показывает, что продукт взаимодействия метионина с 0,2 % раствором нингидрина в ацетоне подчиняется закону светопоглощения при длине волны 400 нм в концентрациях от 0,005 до 0,02 мг/мл. | ||
| + | |||
| + | С целью установления аналитических возможностей оптимизированных условий нингидриновой реакции, нами проведен спектральный анализ раствора нингидрина в ацетоне после его нагревания при температуре 100 °С, без добавления раствора а-аминокислоты (табл. 5). Продукт реакции разбавляли водой до 100 мл. | ||
| + | |||
| + | '''Таблица 5. Спектральный анализ 0,2 % ацетонового раствора нингидрина''' | ||
| + | |||
| + | <table cellpadding="7" border="1"> | ||
| + | <tr><td> | ||
| + | <p>№ п/п</p></td><td> | ||
| + | <p>Диапазон длин волн, нм</p></td><td> | ||
| + | <p>Значения оптической плотности</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>220-240</p></td><td> | ||
| + | <p>0,88340-0,82691</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>2</p></td><td> | ||
| + | <p>240-270</p></td><td> | ||
| + | <p>0,64921-0,59522</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>3</p></td><td> | ||
| + | <p>400-405</p></td><td> | ||
| + | <p>0,17690-0,16592 .</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>4</p></td><td> | ||
| + | <p>560-570</p></td><td> | ||
| + | <p>0,13250-0,1100</p></td></tr> | ||
| + | </table> | ||
| + | |||
| + | Спектральный анализ показал, что раствор нингидрина в ацетоне имеет светопоглощение в тех же диапазонах длин волн, что и продукты его реакции с аминокислотами. Возможно, при нагревании происходит взаимодействие ацетона с нингидрином, и образуются продукты, которые поглощают в УФ- и видимой области спектров. Таким образом, ацетоновый раствор нингидрина может быть использован для количественного определения а-аминокислот только при условии сравнительного анализа спектральных данных продукта реакции анализируемой а-аминокислоты и раствора нингидрина, что существенно усложняет проведение анализа. Кроме того, ацетон является летучим, токсичным и пожароопасным растворителем, что ограничивает его использование. | ||
| + | |||
| + | На этом основании нами изучены продукты нингидриновой реакции в нелетучем растворителе - диметилсульфоксиде (ДМСО). | ||
| + | |||
| + | == Исследование реакции а-аминокислот с 0,2 % раствором нингидрина в диметилсульфоксиде == | ||
| + | |||
| + | В следующей серии экспериментов в качестве растворителя для нингидрина мы использовали диметилсульфоксид (ДМСО). Растворы нингидрина в ДМСО часто используют для количественного определения аминокислот с помощью аминокислотных анализаторов [1]. Важно отметить, что ДМСО имеет преимущества по сравнению с ацетоном: данный растворитель нелетучий, имеет невысокую токсичность, взрыво- и пожаробезопасен, что обеспечивает удобство его использования. | ||
| + | |||
| + | В экспериментах, на основании ранее оптимизированных условий реакции, мы использовали 0,2 % раствор нингидрина в ДМСО. | ||
| + | |||
| + | Нами исследованы спектры поглощения продуктов реакции 20-ти а-аминокислот с 0,2 % раствором нингидрина в ДМСО в диапазонах длин волн 220-600 нм. Реакцию проводили в течение 15 мин при температуре 100 °С по методике, которую мы оптимизировали для проведения реакции с раствором нингидрина в ацетоне (см. раздел 1.2.). После полного охлаждения продукты нингидриновой реакции каждой из 20-ти си-аминокислот разбавляли водой в различных соотношениях до получения значений оптической плотности максимумов поглощения от 0,4 до 1,0. Нами установлены три максимума поглощения при 250, 400 и 560-570 нм. Данная закономерность наблюдается для 18-ти из 20-ти а-аминокислот. Исключение составили продукты нингидриновой реакции с триптофаном и пролином, что объясняется особенностями структуры данных а-аминокислот. Продукт нингидриновой реакции триптофана в УФ-области имеет максимум поглощения при 272 нм, в видимой области спектра максимумы поглощений аналогичны другим а-аминокислотам. Продукт реакции раствора нингидрина в ДМСО с пролином окрашен в жёлтый цвет и имеет два максимума поглощения при длинах волн 300 и 340 нм, в видимой области спектра максимумы поглощения отсутствуют, однако имеется четкое плечо в широком диапазоне длин волн 520-600 нм, с достаточно интенсивным поглощением. Важно отметить, что продукты реакции большинства а-аминокислот имеют единые максимумы поглощения при 250 нм и 400 нм. | ||
| + | |||
| + | По аналогии с ацетоновым раствором нингидрина, нами изучена зависимость светопоглощения продукта реакции с 0,2 % раствором нингидрина в ДМСО от концентрации а-аминокислоты при длине волны 400 нм и установлено её подчинение закону светопоглощения Бугера - Ламберта - Бера (рис. 10). | ||
| + | [[Image:Ningidr10.jpg|250px|thumb|right|Рис 10. Калибровочный график продукта реакции глицина]] | ||
| + | |||
| + | На рис. 10 приведен калибровочный график, который показывает, что продукт реакции глицина с 0,2 % раствором нингидрина в ДМСО при длине волны 400 нм подчиняется закону светопоглощения в концентрации глицина от 0,03 до 0,19 мг/мл. | ||
| + | |||
| + | Для выяснения аналитических возможностей реакции нами изучены спектральные характеристики 0,2 % раствора нингидрина в ДМСО в условиях ее проведения, где вместо раствора а-аминокислоты добавляли равное количество воды. После полного охлаждения продукт реакции разбавляли водой до 100 мл. (табл. 6). | ||
| + | |||
| + | '''Таблица 6. Спектральный анализ 0,2 % раствора нингидрина в ДМСО''' | ||
| + | |||
| + | <table cellpadding="7" border="1"> | ||
| + | <tr><td> | ||
| + | <p>№ п/п</p></td><td> | ||
| + | <p>Длина волны, нм</p></td><td> | ||
| + | <p>Значение оптической плотности</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>250</p></td><td> | ||
| + | <p>0,86921</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>3</p></td><td> | ||
| + | <p>400</p></td><td> | ||
| + | <p>0,18491</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>4</p></td><td> | ||
| + | <p>560-570</p></td><td> | ||
| + | <p>0,20470</p></td></tr> | ||
| + | </table> | ||
| + | |||
| + | Спектральный анализ показал, что раствор нингидрина в ДМСО, также как и в ацетоне поглощает в тех же диапазонах, в которых имеют поглощение и продукты его реакции с а аминокислотами, что существенно усложняет проведение анализа. | ||
| + | |||
| + | == Исследование реакции а-аминокислот с 0,2 % водным раствором нингидрина == | ||
| + | |||
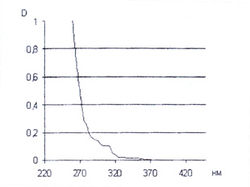
| + | Для качественного и количественного анализа а-аминокислот достаточно часто используют водный раствор нингидрина [7, 13, 20]. На этом основании нами исследованы спектральные характеристики 0,2 % водного раствора нингидрина после его нагревания при температуре 100 °С в течение 15 мин и установлено, что водный раствор нингидрина имеет интенсивное поглощение в диапазоне длин волн 220-300 нм, но совершенно не поглощает в диапазоне длин волн от 400 до 600 нм (рис. 11). | ||
| + | [[Image:Ningidr11.jpg|250px|thumb|right|Рис 11. Спектр поглощения водного раствора нингидрина после нагревания при температуре 100 °С в течение 15 мин]] | ||
| + | |||
| + | Учитывая, что вода является наиболее доступным и безопасным растворителем, наиболее целесообразно проводить спектрофотометрическое исследование продуктов реакции с 0,2 % водным раствором нингидрина в видимой области спектра в диапазоне длин волн - от 400 до 600 нм. | ||
| + | |||
| + | === Изучение спектральных характеристик продуктов реакции а-аминокислот с 0,2 % водным раствором нингидрина === | ||
| + | |||
| + | Нами проведена нингидриновая реакция с 0,2 % водным раствором нингидрина по методике, указанной в ФСП на кислоту глутаминовую [10]. После полного охлаждения продукты нингидриновой реакции каждой из 20-ти а-аминокислот разбавляли водой в различных соотношениях до получения значений оптической плотности максимумов поглощения от 0,4 до 1,0. и изучали спектральные характеристики продуктов для 20-ти о-аминокислот в диапазоне длин волн 380-600 нм. Было установлено, что спектры поглощения имеют единый максимум при длине волны 400±2 нм и в диапазоне длин волн 550-560 нм. | ||
| + | |||
| + | Исключение составляют продукты реакции с цистеином, пролином и гистидином. Продукт реакции с цистеином характеризуется низкой интенсивностью поглощения в видимой области и имеет максимум при длине волны 450 нм. Пролин -единственная о-аминокислота, в структуре которой отсутствует первичная аминогруппа, этим объясняется отсутствие характерного (при 400 нм) максимума поглощения в видимой области спектра. Однако в диапазоне 395-402 нм отмечается четкое плечо с достаточно интенсивным поглощением. Продукт реакции с гистидином имеет недостаточную интенсивность поглощения в видимой области спектра. Важно отметить, что большинство продуктов реакции характеризуются единым максимумом поглощения при 400 нм (рис. 12-15). | ||
| + | [[Image:Ningidr12.jpg|250px|thumb|right|Рис 12. Спектры поглощения продуктов реакции а-аминокислот с 0,2 % водным раствором нингидрина]] | ||
| + | |||
| + | [[Image:Ningidr13.jpg|250px|thumb|right|Рис 13. Спектры поглощения продуктов реакции а-аминокислот 0,2 % водным раствором нингидрина]] | ||
| + | |||
| + | [[Image:Ningidr14.jpg|250px|thumb|right|Рис 14. Спектры поглощения продуктов реакции а-аминокислот с 0,2 % водным раствором нингидрина]] | ||
| + | |||
| + | [[Image:Ningidr15.jpg|250px|thumb|right|Рис 15. Спектры поглощения продуктов реакции а-аминокислот с 0,2 % водным раствором нингидрина]] | ||
| + | |||
| + | Таким образом, наиболее целесообразно проводить реакцию с использованием водного раствора нингидрина с последующим определением оптической плотности её продукта при длине волны 400 нм. | ||
| + | |||
| + | === Оптимизация условий проведения реакции a-аминокислот с ОД % водным раствором нингидрина === | ||
| + | |||
| + | Нами изучено влияние важнейших факторов (соотношение компонентов реакции, продолжительность и температурный режим) на стабильность и значение оптической плотности при длине волны 400 нм продуктов взаимодействия a-аминокислот с водным раствором нингидрина. Для анализа мы использовали глицин. | ||
| + | |||
| + | При проведении реакции в условиях, указанных в ФСП на кислоту глутаминовую [10], нами установлено, что продукт реакции характеризуется низкой стабильностью значения оптической плотности при длине волны 400 нм во времени. | ||
| + | |||
| + | Поэтому, мы провели оптимизацию количественных соотношений между компонентами. Реакцию проводили при температуре 100 °С в течение 15 мин. | ||
| + | |||
| + | Продукты, после полного охлаждения, разбавляли водой (табл. 7). | ||
| + | |||
| + | '''Таблица 7. Оптимизация количественных соотношений компонентов реакции''' | ||
| + | |||
| + | <table cellpadding="7" border="1"> | ||
| + | <tr><td> | ||
| + | <p>№ п/п</p></td><td colspan="3"> | ||
| + | <p>Количественные соотношения между компонентами реакции</p></td><td> | ||
| + | <p>Разведени</p> | ||
| + | <p>е</p></td><td colspan="2"> | ||
| + | <p>Оптическая плотность продукта при λ=400 нм</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p></p></td><td> | ||
| + | <p>Навеска глицина, г</p></td><td> | ||
| + | <p>Объем раствора глицина, мл</p></td><td> | ||
| + | <p>Объем 0,2 % водного раствора нингидрина, мл</p></td><td> | ||
| + | <p>продукта</p> | ||
| + | <p>реакции</p> | ||
| + | <p>водой</p></td><td> | ||
| + | <p>Через 1 ч после начала реакции</p></td><td> | ||
| + | <p>Снижение значения за период 1-2 ч после начала реакции, %</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>2</p></td><td> | ||
| + | <p>3</p></td><td> | ||
| + | <p>4</p></td><td> | ||
| + | <p>5</p></td><td> | ||
| + | <p>6</p></td><td> | ||
| + | <p>7</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>0,02</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>До 50 мл</p></td><td> | ||
| + | <p>0,61047</p></td><td> | ||
| + | <p>19</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>2</p></td><td> | ||
| + | <p>0,01</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>до 100 мл</p></td><td> | ||
| + | <p>0,33356</p></td><td> | ||
| + | <p>15</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>3</p></td><td> | ||
| + | <p>0,005</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>до 100 мл</p></td><td> | ||
| + | <p>0,34825</p></td><td> | ||
| + | <p>11</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>4</p></td><td> | ||
| + | <p>0,0025</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>до 100 мл</p></td><td> | ||
| + | <p>0,36545</p></td><td> | ||
| + | <p>7</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>5</p></td><td> | ||
| + | <p>0,001</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>до 100 мл</p></td><td> | ||
| + | <p>0,36835</p></td><td> | ||
| + | <p>2</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>6</p></td><td> | ||
| + | <p>0,0005</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>до 50 мл</p></td><td> | ||
| + | <p>0,36156</p></td><td> | ||
| + | <p>6</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>7</p></td><td> | ||
| + | <p>0,001</p></td><td> | ||
| + | <p>1,25</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>до 100 мл</p></td><td> | ||
| + | <p>0,33295</p></td><td> | ||
| + | <p>5</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>8</p></td><td> | ||
| + | <p>0,001</p></td><td> | ||
| + | <p>0,75</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>до 100 мл</p></td><td> | ||
| + | <p>0,37382</p></td><td> | ||
| + | <p>6</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>9</p></td><td> | ||
| + | <p>0,001</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>0,9</p></td><td> | ||
| + | <p>до 100 мл</p></td><td> | ||
| + | <p>0,34526</p></td><td> | ||
| + | <p>9</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>10</p></td><td> | ||
| + | <p>0,001</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>1Д</p></td><td> | ||
| + | <p>до 100 мл</p></td><td> | ||
| + | <p>0,38110</p></td><td> | ||
| + | <p>1</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>11</p></td><td> | ||
| + | <p>0,001</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>1,2</p></td><td> | ||
| + | <p>до 100 мл</p></td><td> | ||
| + | <p>0,38474</p></td><td> | ||
| + | <p>5</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>12</p></td><td> | ||
| + | <p>0,001</p></td><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>1,3</p></td><td> | ||
| + | <p>до 100 мл</p></td><td> | ||
| + | <p>0,38557</p></td><td> | ||
| + | <p>7</p></td></tr> | ||
| + | </table> | ||
| + | |||
| + | Из данных таблицы видно, что наиболее стабильный продукт во времени наблюдается при проведении реакции между 1 мл 0,1 % раствором глицина и 1,1 мл 0,2 % водного раствора нингидрина (значение оптической плотности за период времени 1-2 ч после начала реакции снижается на 1 %). | ||
| + | |||
| + | Нами также изучено влияние температуры, и продолжительности реакции во времени на стабильность продуктов (табл. 8). | ||
| + | |||
| + | '''Таблица 8. Оптимизация температурного режима и продолжительности реакции''' | ||
| + | |||
| + | <table cellpadding="7" border="1"> | ||
| + | <tr><td rowspan="2"> | ||
| + | <p>№ п/п</p></td><td rowspan="2"> | ||
| + | <p>Температурный режим реакции, °С</p></td><td rowspan="2"> | ||
| + | <p>Продолжительность проведения реакции, мин</p></td><td rowspan="2"> | ||
| + | <p>Разведение продукта реакции водой</p></td><td colspan="2"> | ||
| + | <p>Оптическая плотность продукта при λ=400 нм</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>Через 1 ч после начала реакции</p></td><td> | ||
| + | <p>Снижение значения за период 1-2 ч после начала реакции, %</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>1</p></td><td> | ||
| + | <p>80</p></td><td> | ||
| + | <p>15</p></td><td> | ||
| + | <p>До 100 мл</p></td><td> | ||
| + | <p>0,33638</p></td><td> | ||
| + | <p>5</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>2</p></td><td> | ||
| + | <p>90</p></td><td> | ||
| + | <p>15</p></td><td> | ||
| + | <p>До 100 мл</p></td><td> | ||
| + | <p>0,36167</p></td><td> | ||
| + | <p>2,5</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>3</p></td><td> | ||
| + | <p>100</p></td><td> | ||
| + | <p>15</p></td><td> | ||
| + | <p>До 100 мл</p></td><td> | ||
| + | <p>0,38110</p></td><td> | ||
| + | <p>1</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>4</p></td><td> | ||
| + | <p>110</p></td><td> | ||
| + | <p>15</p></td><td> | ||
| + | <p>До 100 мл</p></td><td> | ||
| + | <p>0,39667</p></td><td> | ||
| + | <p>1</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>5</p></td><td> | ||
| + | <p>120</p></td><td> | ||
| + | <p>15</p></td><td> | ||
| + | <p>До 100 мл</p></td><td> | ||
| + | <p>0,41112</p></td><td> | ||
| + | <p>1</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>6</p></td><td> | ||
| + | <p>130</p></td><td> | ||
| + | <p>15</p></td><td> | ||
| + | <p>До 100 мл</p></td><td> | ||
| + | <p>0,37312</p></td><td> | ||
| + | <p>4</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>7</p></td><td> | ||
| + | <p>120</p></td><td> | ||
| + | <p>25</p></td><td> | ||
| + | <p>До 100 мл</p></td><td> | ||
| + | <p>0,35289</p></td><td> | ||
| + | <p>5</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>8</p></td><td> | ||
| + | <p>120</p></td><td> | ||
| + | <p>22,5</p></td><td> | ||
| + | <p>До 100 мл</p></td><td> | ||
| + | <p>0,43140</p></td><td> | ||
| + | <p>2,5</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>9</p></td><td> | ||
| + | <p>120</p></td><td> | ||
| + | <p>20</p></td><td> | ||
| + | <p>До 100 мл</p></td><td> | ||
| + | <p>0,45056</p></td><td> | ||
| + | <p>0,5</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>10</p></td><td> | ||
| + | <p>120</p></td><td> | ||
| + | <p>17,5</p></td><td> | ||
| + | <p>До 100 мл</p></td><td> | ||
| + | <p>0,43273</p></td><td> | ||
| + | <p>1</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>11</p></td><td> | ||
| + | <p>120</p></td><td> | ||
| + | <p>12,5</p></td><td> | ||
| + | <p>До 100 мл</p></td><td> | ||
| + | <p>0,40105</p></td><td> | ||
| + | <p>3</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>8</p></td><td> | ||
| + | <p>120</p></td><td> | ||
| + | <p>10</p></td><td> | ||
| + | <p>До 100 мл</p></td><td> | ||
| + | <p>0,38908</p></td><td> | ||
| + | <p>2</p></td></tr> | ||
| + | <tr><td> | ||
| + | <p>9</p></td><td> | ||
| + | <p>120</p></td><td> | ||
| + | <p>7,5</p></td><td> | ||
| + | <p>До 100 мл</p></td><td> | ||
| + | <p>0,34934</p></td><td> | ||
| + | <p>5</p></td></tr> | ||
| + | </table> | ||
| + | |||
| + | Анализ данных таблицы показывает, что наиболее стабильные и высокие значения оптической плотности наблюдаются при проведении реакции в течение 20 мин при температуре 120 ^С. Следует отметить, что период времени 1-1,5 ч после начала реакции характеризуется максимальной стабильностью продукта: значение D остается постоянным с точностью до 0,001. При использовании растворов нингидрина в ацетоне и ДМСО стабильность продуктов реакции значительно ниже. Кроме того, как было описано выше, сам нингидрин в ацетоновом растворе и в растворе ДМСО имеет светопоглощение в тех же диапазонах, что и продукты его реакции с а-аминокислотами. Учитывая доступность и безопасность, вода является наиболее рациональным растворителем для приготовления нингидринового реактива. | ||
| + | |||
| + | С целью изучения возможности взаимодействия нингидрина с водой, нами изучены спектральные характеристики 0,2 % водного раствора нингидрина в оптимизированных условиях проведения нингидриновой реакции (при температуре 120 °С в течение 20 мин), однако вместо раствора а-аминокислоты мы добавили равное количество воды. Установлено, что исследуемый раствор не поглощает в диапазоне длин волн 350-600 нм, в то время как продукты реакции а-аминокислот с водным раствором нингидрина имеют четкий максимум поглощения именно при 400±2 нм, что позволяет использовать эту длину волны для количественной оценки а-аминокислот. | ||
| + | |||
| + | Таким образом, на примере глицина нами установлены оптимальные условия проведения нингидриновой реакции: к 1 мл 0,1 % раствора а-аминокислоты добавляют 1,1 мл 0,2 % водного раствора нингидрина и нагревают при температуре 120 °С в течение 20 мин. После полного охлаждения продукт реакции разбавляют водой до 100 мл и спустя 1 ч после начала реакции на спектрофотометре определяют значение оптической плотности при длине волны 400 нм в кюветах с толщиной поглощающего слоя 10 мм. | ||
| + | |||
| + | Нами установлено, что указанные выше условия проведения нингидриновой реакции являются наиболее оптимальными для большинства а-аминокислот. | ||
| + | |||
| + | Исключение составили следующие а-аминокислоты: цистеин, тирозин, аспарагиновая кислота и лизин. Цистеин и тирозин, вследствие их низкой растворимости в воде, мы использовали в виде менее концентрированных 0,04 % растворов, увеличив их объёмы до 2,5 мл. При этом 0,2 % водный раствор нингидрина добавляли в эквимолярных количествах по отношению к указанным о-аминокислотам: 0,7 мл - к 2,5 мл 0,04 % раствора цистеина и 0,5 мл - к 2,5 мл 0,04 % раствора тирозина. | ||
| + | |||
| + | Продукты реакции аспарагиновой кислоты и лизина с 0,2 % водным раствором нингидрина отличаются невысокими значениями оптической плотности при длине волны 400 нм. Аспарагиновая кислота — дикарбоновая а-аминокислота, лизин - а-аминокислота содержащая в радикале первичную аминогруппу. По-видимому, за счёт наличия в указанных аминокислотах дополнительных карбоксильной и аминогрупп изменяется pH реакционной среды, что приводит к частичному разложению продуктов реакции. На этом основании мы увеличили объёмы реагентов в 2 раза, т.е. по 2,2 мл 0,2 % водного раствора нингидрина добавляли к 2 мл 0,1 % растворам аспарагиновой кислоты и лизина. Кроме того, для лизина, вследствие нестойкости продукта его реакции с нингидрином, оптимальная продолжительность нагревания составляет 2 мин. Спектры продуктов взаимодействия нингидрина с данными а-аминокислотами снимают на спектрофотометре без предварительного разведения. | ||
| + | |||
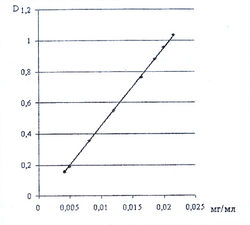
| + | На основании оптимизированных условий проведения реакции а-аминокислот с 0,2 % водным раствором нингидрина нами была изучена зависимость светопоглощения продукта реакции от концентрации о-аминокислоты при длине волны 400 нм (рис. 16). | ||
| + | [[Image:Ningidr16.jpg|250px|thumb|right|Рис 16. Калибровочный график продукта реакции глицина]] | ||
| + | |||
| + | На рис. 16 приведен калибровочный график, который показывает, что продукт взаимодействия глицина с 0,2 % водным раствором нингидрина подчиняется закону светопоглощения в концентрации от 0,005 до 0,025 мг/мл. | ||
| + | |||
| + | == Заключение == | ||
| + | |||
| + | Таким образом, на основании исследования спектральных характеристик продуктов реакции а-аминокислот с нингидрином в различных растворителях установлены единые максимумы поглощения для большинства а-аминокислот: в УФ- (в диапазоне длин волн 220-260 нм) и видимой областях спектра (при длине волны 400±2 нм, а также в диапазоне длин волн 560-570 нм). | ||
| + | |||
| + | Оптимизация условий проведения нингидриновой реакции показала, что продукты реакции а-аминокислот с водным раствором нингидрина характеризуются наибольшей стабильностью во времени и имеют единый максимум поглощения при длине волны 400±2 нм. Поэтому, наиболее целесообразно проводить нингидриновую реакцию с водным раствором нингидрина, с последующим спектрофотометрическим определением продуктов при длине волны 400 нм. | ||
| + | |||
| + | На этом основании разработаны методы количественного определения а-аминокислот в лекарственных препаратах и растительном сырье, основанные на реакции с 0,2 % водным раствором нингидрина. Разработанные методы отличаются достаточной точностью (относительная ошибка результата отдельного определения для всех образцов не превышает ±3 %) и доступностью. | ||
| + | |||
| + | == Читайте также == | ||
*[[Количественное определение глицина в таблетках]] | *[[Количественное определение глицина в таблетках]] | ||
*[[Количественное определение белка в продуктах]] | *[[Количественное определение белка в продуктах]] | ||
| + | *[[Допинг-контроль: методы и тесты]] | ||
| + | |||
| + | == Список литературы == | ||
| + | |||
| + | 1. Аминокислотный и минеральный состав надземной части Atragene Speciosa / И.В. Шилова, Е.А. Краснов, Н.В. Барановская и др. // Хим.-фарм. журн. - 2002. | ||
| + | |||
| + | 2. Аникина Н.В. Спектрофотометрическое определение цистина / Н.В. Аникина, М.Е. Пудель // Хим.-фарм. журн. -1983. - Т. 17, №2.- С.244-245. | ||
| + | |||
| + | 3. Бондаренко Б.Н. Количественное определение аминокислот при хроматографии в тонком слое / Б.Н. Бондаренко // Лаб. дело. —1984. - №2. — С. 118-120. | ||
| + | |||
| + | 4. Бородина B.JI. Экспресс-метод количественного определения аминокислот с помощью газожидкостной хроматографии / B.J1. Бородина, А.И. Крылов, В.А. Рогозкин // Лаб. дело. —1984.— №7. — С. 395—397. | ||
| + | |||
| + | 5. Великанова О.Ф. Спектрофотометрический метод определения суммарного количества аминокислот в сыворотке крови / О.Ф. Великанова, Ю.В. Галаев // Лаб. дело. - 1981. - № 11. - С. 701-702. | ||
| + | |||
| + | 6. Глицин таблетки сублингвальные 0,1 г.: ФСП 42-0025265-02-99. — 07.06.2002. | ||
| + | |||
| + | 7. Государственная фармакопея СССР. — XI - изд. — М.: Медицина, 1989. - Вып 2. -400 с. | ||
| + | |||
| + | 8. Доссон Р. Справочник биохимика / Р. Доссон, Д. Эллиот - М.: Мир, 1991. - 544 -С. | ||
| + | |||
| + | 9. Изучение аминокислотной фракции экстракта мумие сухого / ТЛ. Киселева, Л.Н. Фролова, ЛА. Баратова и др. // Хим.-фарм. журн. - 1998. - Т. 32, № 2. - С. 47-51. | ||
| + | |||
| + | 10. Кислота глютаминовая: ВФС 42-2722-96. - 25.04.96. | ||
| + | |||
| + | 11. Количественное определение аминокислот в пыльце (обножке) / И.В. Духанина,А.Ю. Айрапетова, Г.Д. Лазарян. и др. // Хим.-фарм. журн. - 2006. - Т. 40, № 2. -С. 22-23. | ||
| + | |||
| + | 12. Колориметрические методы анализа азотистых соединений: Метод, реком / Волгогр. сельхоз. ин-т, кафедра химии; Сост. В.А. Храмов. - Волгоград, 1979.- 15 с. | ||
| + | |||
| + | 13. Копытко Я.Ф. Аминокислоты и жирные кислоты настоек Парнасия (Белозора болотного) гомеопатических матричных / Я.Ф. Копытко // Хим.-фарм. журн. -2003. -Т. 37, № 7. | ||
| + | |||
| + | 14. Крищенко В.П. Комплексная методика определения аминокислот в различных фракциях азотного комплекса растений / В.П. Крищенко // Изв. АН СССР. Сер. Биология. - 1978. - № 3! - С. 327-331. | ||
| + | |||
| + | 15. Лазарян Д.С. Сравнительное изучение аминокислотного состава расплода пчел / Д.С. Лазарян // Хим.-фарм. журн. - 2002. - Т. 36, № 12. - С. 42-44. | ||
| + | |||
| + | 16. Мансурова И.Д. Определение количества оксилизина и лизина в сыворотке крови / Й.Д. Мансурова, Е.Н. Набиджанова // Лаб. дело. - 1982. - № 8. - С. 459-461. | ||
| + | |||
| + | 17. Методы биохимического исследования растений / Под ред. А.И. Ермаковой. -Л : Химия, 1977.-540 с. | ||
| + | |||
| + | 18. Половодова Н.В. Разработка спектрофотометрической методики определения кислоты аспарагиновой на основе реакции с нингидрином / Н.В. Половодова // Молодежная наука Прикамье - 2002: Тез. докл. Обл. науч. конф. молодых ученых, студентов и аспирантов, Пермь, 6-9 декабря 2002 г. - Пермь, 2002.- С. 162. | ||
| + | |||
| + | 19. Россихина А.В. Разработка способа определения калия аспарагината в препарате «Аспаркам» / А.В. Россихина // Молодежная наука Прикамье - 2002: Тез. докл. Обл. науч. конф. молодых ученых, студентов и аспирантов, Пермь, 6-9 декабря 2002 г. - Пермь, 2002. - С. 163. | ||
| + | |||
| + | 20. Стандартизация рогов и пантов северного оленя. 1. Количественное определение нингидринактивных веществ в порошке рогов северного оленя /В.П. Пахомов, Т.В. Максимова, И.Н. Никулина и др. // Хим.-фарм. журн. - 1997. -Т. 31,№4.-С. 53-54. | ||
| + | |||
| + | 21. Тихонов Б.Б. Применение метода капиллярного электрофореза для исследования аминокислотного состава белков амаранта / Б.Б. Тихонов П Вестн. Тверск. гос. техн. ун-та. - 2002. - № 2. - С. 128-130. | ||
| + | |||
| + | 22. УФ-спектрофотометрическое определение ароматических аминокислот / Е.Р. Рошаль, В.Н. Сенаторова, А.Ф. Шолин и др. // Хим.-фарм. журн. - 1991. - Т. 25,№4.-С. 80-83. | ||
| + | |||
| + | 23. Химия биологически активных и природных соединений / Под ред. Н.А. Преображенского, Р.П. Евстигнеевой. - М.: Химия, 1970. - 512 с. | ||
| + | |||
| + | 24. Цистеин: ВФС 42-2633-96. - 20.02.96. | ||
| + | |||
| + | 25. Chen Bing. Одновременное определение аминокислот в пищевых продуктах методом капиллярного электрофореза при косвенном детектировании в УФ-лучах / Chen Bing , Li Xiaoge, He Ping // Chin. J. Chromatogr. - 2004. - VOL. 22, № 1.-P. 74-76. | ||
| + | |||
| + | 26. Fu Min. Определение следовых количеств аминокислот нейротрансмиттеров в плазме крови крыс методом капиллярного электрофореза в сочетании с детектированием флуоресценции, индуцированной диодным лазером / Fu Min, Zhang Dongming, Ma Wanyan // Chin. J. Anal. Chem. - 2003. - VOL. 31, № 3. - P. 296-299. | ||
| + | |||
| + | 27. Garcia-Willar N. Liquid chromatographic determination of lysine by potentiometric detection with biosensor / N. Garcia-Willar, Hemandes-Cassou // Anal. Lett. -2002.-№8.-P. 1313-1323. | ||
| + | |||
| + | 28. Gatte R. Phanquenone: a useful fluorescent pre-chromatographic derivatization reagent for liquid chromatographic analyses of aminoacid dosage form / R. Gatte, M.G. Gioia, A.M. Di Pieta // Anal. chem. acta. - 2002. - № 1-2. - P. 11-20. | ||
| + | |||
| + | 29. Khan A.A. Studies of the kinetics and mechanism of interaction of ot-aminoacids with ninhydrin // J. Indian Chem. Soc. - 1989. - VOL. 66, № 7. - P. 454-456. | ||
| + | |||
| + | 30. Kuryt T. Quantitative analysis of amino acids in biological fluids by gas chromatography with flame ionization detection / T. Kuryt, D. Sawnor-Corszynska // Acta chromatogr. - 2000. - № 10. - P. 97-103. | ||
| + | |||
| + | 31. Yu Hong. Определение аминокислот и глюкозы в аминокислотных инъекционных растворах методом анионообменной хроматографии с интегрированным импульсным амперометрическим детектированием | ||
Текущая версия на 13:57, 21 мая 2014
Содержание
- 1 Спектрофотометрическое исследование продуктов нингидриновой реакции
- 2 Исследование спектральных характеристик продуктов реакции а-аминокислот с 0,2 % раствором нингидрина в ацетоне
- 3 Оптимизация условий реакции а-аминокислот с 0,2 % раствором нингидрина в ацетоне
- 4 Исследование реакции а-аминокислот с 0,2 % раствором нингидрина в диметилсульфоксиде
- 5 Исследование реакции а-аминокислот с 0,2 % водным раствором нингидрина
- 6 Заключение
- 7 Читайте также
- 8 Список литературы
Спектрофотометрическое исследование продуктов нингидриновой реакции[править | править код]
Разработка точных, доступных методов анализа а-аминокислот является одной из актуальных задач современной фармации, в данной статье описан простой и доступный способ определения аминокислот и протеина в различных продуктах, включая биологически-активные добавки и спортивное питание.
В настоящее время существует ряд методов количественного определения а-аминокислот в лекарственном растительном сырье, в лекарственных препаратах и биологических жидкостях [1—31]. Однако, несмотря на высокую точность, их применение ограничено длительностью приготовления рабочих растворов (потенциометрическое титрование в неводной среде), дороговизной оборудования (ГЖХ, ВЭЖХ) [4, 6,27,28, 30].
Для анализа а-аминокислот также широко используют методы, основанные на реакции с нингидрином [1,3, 8,9, 11-20,23, 29].
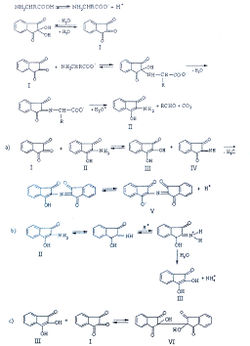
Khan А. с соавторами изучили механизм нингидриновой реакции [29]:
На первой стадии реакции о-аминокислот с нингидрином (I) образуются углерода диоксид, альдегид и устойчивое промежуточное соединение - 2-аминоиндандион (II), участвующий в двух параллельных реакциях. В одной из них он реагирует с нингидрином до образования 2-гидроксииндандиона (III) и 2-иминоиндандиона (IV), которые, конденсируясь между собой, формируют дикетогидринденкетогидринамин (V). Во второй реакции 2-аминоиндандион в кислой среде подвергается гидролизу до аммиака и 2-гидроксииндандиона, последний, взаимодействуя с нингидрином, образует гидриндантин (VI).
Установлено, что характерная для большинства а-аминокислот пурпурная окраска(окраска Румана) обусловлена образованием дикетогидринденкетогидринамина (V), а также продукта параллельной реакции - гидриндантина (VI), который мало растворим в воде и растворим в органических растворителях - диметилсульфоксиде (ДМСО) и метилцелозольве. Поэтому, с целью повышения чувствительности реакции, по предположению авторов, наиболее рационально использовать растворы нингидрина в указанных растворителях. Максимальные значения оптической плотности продуктов реакции (при длине волны 575 нм) наблюдаются при соблюдении следующих условий ее проведения: температура реакционной смеси - 95 °С, pH — 5-6. Кроме того, реакцию необходимо проводить без доступа кислорода, в атмосфере азота.
Для детектирования продукта нингидриновой реакции используют спектрофотометры, флуориметры.
Широкое распространение в анализе аминокислот получили аминокислотные анализаторы [1,9,11,13—15, 17]. Данный метод основан на разделении аминокислот с помощью ионообменной хроматографии с последующим фотоколориметрическим определением продуктов реакции аминокислот с нингидрином. Применение аминокислотных анализаторов позволяет разделить исследуемый образец на отдельные компоненты и определить их количество быстро и с высокой точностью. Главным недостатком данного метода анализа является высокая стоимость оборудования, что делает его недоступным для большинства лабораторий.
Более доступными и простыми являются фотоколориметрические и спектрофотометрические методы анализа о-аминокислот, основанные на их взаимодействии с нингидрином. Так, В.А. Храмовым модифицирован метод определения диаминокислот по Чинарду [12]. Метод основан на образовании красно-коричневых продуктов взаимодействия диаминокислот с нингидрином с последующим фотоколориметрическим определением при длине волны 490 нм. Метод является специфичным: нейтральные аминокислоты, а также амины и диамины при pH 1 с нингидрином окрашенных продуктов не образуют. Несмотря на доступность и простоту данный метод не является универсальным для всех а-аминокислот и позволяет определить лишь диаминокислоты, из которых наибольшее практическое значение имеет незаменимая аминокислота лизин. Кроме того, этим методом можно определить пролин.
Разработана точная методика количественного определения кислоты аспарагиновой в лекарственном препарате «Аспаркам», основанная на ее взаимодействии с 1 % этаноловым раствором нингидрина и последующим определением оптической плотности продукта реакции при длине волны 568 нм. Метод отличается хорошей воспроизводимостью, относительная ошибка среднего результата составила ±2,25 % [19]. Кроме того, предложен спектрофотометрический метод анализа суммы аминокислот различных видов пыльцы, основанный на взаимодействии с 2 % этаноловым раствором нингидрина [11].
С этих позиций представляет интерес изучение спектральных характеристик продуктов нингидриновой реакции 20-ти наиболее важных в биологическом отношении а-аминокислот, оптимизация условий ее проведения с целью разработки точного и доступного метода количественного определения а-аминокислот в растительном сырье, субстанциях и суммарных лекарственных препаратах.
Исследование спектральных характеристик продуктов реакции а-аминокислот с 0,2 % раствором нингидрина в ацетоне[править | править код]
В соответствии с ГФ XI наиболее часто в хроматографических методах анализа а-аминокислот используют 0,2 % раствор нингидрина в ацетоне [3, 8]. На этом основании мы изучили спектры продуктов реакции для 20-ти а-аминокислот с ОД % раствором нингидрина в ацетоне с целью создания нового метода количественного анализа аминокислот в различных объектах.
Нингидриновую реакцию проводили по методике, указанной в ФСП на кислоту глутаминовую в разделе «подлинность»: к 1 мл 2 % раствора а-аминокислоты прибавляют 1 мл свежеприготовленного 0,2 % раствора нингидрина в ацетоне и нагревают до появления сине-фиолетовой окраски [10]. Цистеин и тирозин, вследствие их низкой растворимости в воде, использовали в виде менее концентрированных 0,04 % растворов. После полного охлаждения продукты нингидриновой реакции каждой из 20-ти а-аминокислот разбавляли водой в различных соотношениях до получения значений оптической плотности максимумов поглощения от 0,4 до 1,0.
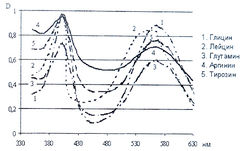
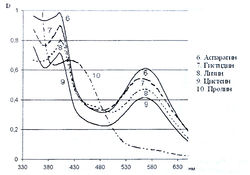
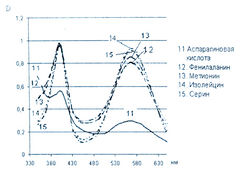
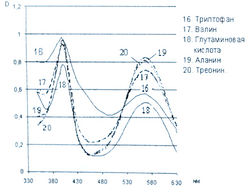
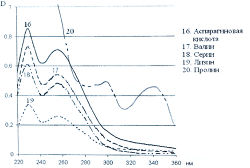
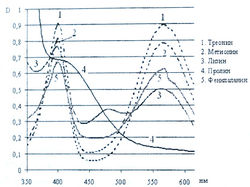
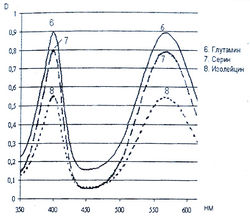
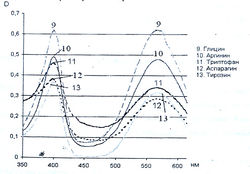
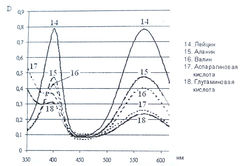
Исследование спектров поглощения в видимой области показало наличие двух максимумов в диапазонах длин волн 399-405 и 560-570 нм. Данная закономерность наблюдается для 19-ти из 20-ти а-аминокислот (рис. 1-4). Исключение составляет пролин, продукт реакции которого с нингидрином имеет один максимум поглощения в видимой области — при длине волны 416 нм, что объясняется отсутствием первичной аминогруппы в структуре данной аминокислоты.
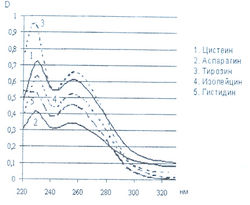
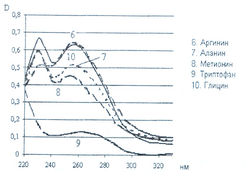
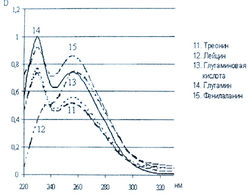
Исследована также УФ-область спектра продуктов реакции 20-ти а-аминокислот с 0,2 % раствором нингидрина в ацетоне и установлено, что все они также имеют два максимума поглощения в диапазонах длин волн 220-237 и 254-260 нм (рис. 5-8). Исключение составляет продукт реакции с пролином, максимумы поглощения которого составляют 299 и 343 нм.
Максимумы поглощения (в видимой и УФ-области) продуктов взаимодействия 20-ти а-аминокислот с 0,2 % раствором нингидрина в ацетоне представлены в таблице 1.
Таблица 1. Характеристика спектров поглощения продуктов реакции а-аминокислот с 0,2 % раствором нингидрина в ацетоне.
|
№ |
а-Аминокислота |
Максимумы поглощения | |
|
п/п |
УФ-область |
Видимая область | |
|
1 |
231,251 |
401, 567 | |
|
2 |
232,256 |
400, 561 | |
|
3 |
Аспарагин |
231,256 |
400*568 |
|
4 |
230, 256 |
400,564 | |
|
5 |
Валин |
230, 257 |
400, 560 |
|
6 |
229, 255 |
401, 568 | |
|
7 |
231,256 |
401,568 | |
|
8 |
230, 256 |
401,566 | |
|
9 |
Глутаминовая кислота |
230, 256 |
400, 568 |
|
10 |
Изолейцин |
230, 257 |
399, 565 |
|
11 |
Лейцин |
237, 258 |
400, 565 |
|
12 |
Лизин |
230, 255 |
400, 565 |
|
13 |
230, 254 |
401,566 | |
|
14 |
Серин |
230, 256 |
401,567 |
|
15 |
230, 256 |
402,567 | |
|
16 |
228, 258 |
400, 567 | |
|
17 |
229,263 |
401,568 | |
|
18 |
230, 257 |
401,566 | |
|
19 |
230, 255 |
401, 564 | |
|
20 |
Пролин |
299, 343 |
416 |
Из данных таблицы 1 видно, что для большинства а аминокислот характерны четыре максимума поглощения, два из которых находятся в УФ-области, в интервале длин волн 228-237 и 251-263 нм, и два - в видимой области, в диапазоне 399-402 и 560-568 нм.
Оптимизация условий реакции а-аминокислот с 0,2 % раствором нингидрина в ацетоне[править | править код]
Как установлено нами выше, большинство продуктов реакции а-аминокислот с раствором нингидрина в ацетоне характеризуются единым максимумом поглощения при длине волны 400 нм, что обуславливает целесообразность использования данной длины волны в качестве аналитической.
Нами установлено, что продукты реакции, проведенной по методике, указанной в разделе 1.1, характеризуются низкой стабильностью во времени (для большинства а-аминокислот значение оптической плотности в диапазоне длин волн 399-400 нм и интервале 1-2 ч после начала реакции снижается более чем на 15 %). Поэтому нами изучены оптимальные условия реакции в зависимости от соотношения между ее компонентами (навески и объема раствора о-аминокислоты, объема ОД % раствора нингидрина в ацетоне), продолжительности и температурного режима реакции. Для анализа мы использовали фенилаланин.
С целью изучения влияния количественных соотношений между растворами фенилаланина и нингидрина на стабильность продукта реакции нами проведена серия экспериментов (табл. 2). Реакцию проводили при температуре 100 °С в течение 10 мин (до образования темно-фиолетовой окраски). Продукты после полного охлаждения разбавляли водой и измеряли значение оптической плотности при длине волны 400 нм. О стабильности продуктов реакции мы судили по величине снижения оптической плотности, % за период 1-2 ч после начала реакции.
Таблица 2. Оптимизация количественных соотношений компонентов реакции
|
№ п/п |
Количественные соотношения между компонентами реакции |
Разведение продукта реакции водой |
Оптическая плотность продукта при λ=400 нм | |||
|
Навеска фенилала нина, г |
Объем раствора фенилалани на, мл |
Объем 0,2 % раствора нингидрина в ацетоне, мл |
Через 1 ч после начала реакции |
Снижение значения за период 1-2 ч после начала реакции, % | ||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
1 |
0,02 |
1 |
1 |
1:6 |
0,72747 |
15 |
|
2 |
0,005 |
2,75 |
0,25 |
- |
0,06456 |
- |
|
3 |
0,005 |
2,5 |
0,5 |
1:3 |
0,60825 |
6,5 |
|
4 |
0,005 |
2,25 |
0,75 |
1:4 |
0,75645 |
12,5 |
|
5 |
0,005 |
2 |
1 |
1:5 |
0,75235 |
13,5 |
|
6 |
0,005 |
1,5 |
1,5 |
1:10 |
0,76256 |
14 |
|
7 |
0,005 |
2,25 |
0,5 |
1:3 |
0,57195 |
И |
|
8 |
0,005 |
2,75 |
0,5 |
1:3 |
041382 |
9,5 |
|
9 |
0,004 |
2,5 |
0,5 |
1:3 |
0,51826 |
9 |
|
10 |
0,006 |
2,5 |
0,5 |
1:3 |
0,58310 |
10 |
|
11 |
0,005 |
2,5 |
0,75 |
1:3 |
0,59274 |
10,5 |
|
12 |
0,005 |
2,5 |
0,25 |
1:2 |
0,63057 |
8,5 |
Здесь и далее - показывает соотношения между объемами продукта реакции до и после их разведения водой (мл).
На основании полученных данных нами установлены оптимальные соотношения между компонентами реакции: 2,5 мл 0,2 % раствора о аминокислоты и 0,5 мл 0,2% свежеприготовленного раствора нингидрина в ацетоне. При соблюдении данных условий образуется наиболее стабильный продукт, характеризующийся максимальным значением оптической плотности при длине волны 400 нм,
Мы изучили также влияние продолжительности реакции во времени на величину и стабильность значения оптической плотности продукта (табл. 3). Реакцию проводили с учетом оптимизированных выше соотношений между ее компонентами при температуре 100 °С.
Таблица 3 Оптимизация продолжительности реакции во времени
|
№ п/п |
Продолжительность проведения реакции, мин |
Разведение продукта реакции водой |
Оптическая плотность продукта при λ=400 нм | |
|
Через 1 ч после начала реакции |
Снижение значения за период 1-2 ч после начала реакции, % | |||
|
/ |
2 |
3 |
4 |
5 |
|
1 |
2 |
1:2 |
0,32569 |
10 |
|
2 |
4 |
1:2 |
0,54934 |
9 |
|
3 |
6 |
1:3 |
0,48458 |
8,5 |
|
4 |
8 |
1:3 |
0,56588 |
8 |
|
5 |
10 |
1:3 |
0,60825 |
6,5 |
|
6 |
12 |
1:3 |
0,61945 |
6 |
|
7 |
14 |
1:3 |
0,62521 |
6 |
|
8 |
15 |
1:3 |
0,64187 |
4 |
|
9 |
16 |
1:3 |
0,62891 |
7 |
|
10 |
18 |
1:3 |
0,59476 |
8 |
|
11 |
20 |
1:3 |
0,54398 |
10 |
Анализ данных таблицы 3 показывает, что наиболее стабильный продукт с максимальным значением оптической плотности образуется при проведении реакции в течение 15 мин. Более длительное нагревание приводит к разложению продуктов реакции со значительным снижением оптической плотности. При нагревании реакционной смеси менее 15 мин величина оптической плотности вначале незначительно возрастает, а затем наблюдается резкое снижение ее значения.
Далее мы изучили влияние температурного режима реакции на стабильность значения оптической плотности продукта при длине волны 400 нм. Реакцию проводили в диапазоне температур от 50 до 110 в течение 15 мин (табл. 4).
Таблица 4 Оптимизация температурного режима реакции
|
№ п/п |
Температурный режим реакции, °С |
Разведение продукта реакции водой |
Оптическая плотность продукта при λ=400 нм | |
|
Через 1 ч после начала реакции |
Снижение значения за период 1-2 ч после начала реакции, % | |||
|
1 |
50 |
- |
0,0706 |
- . |
|
2 |
60 |
- |
0,11835 |
- |
|
3 |
70 |
- |
0,25843 |
12 |
|
4 |
S0 |
1:2 |
0,38956 |
8 |
|
5 |
90 |
1:3 |
0,48453 |
6 |
|
6 |
100 |
1:3 |
0,64187 |
4 |
|
7 |
110 |
1:3 |
0,55917 |
10 |
Мы установили, что при температуре ниже 70 °С реакционная смесь характеризуется отсутствием максимумов поглощения в диапазонах длин волн 399-402 и 560-570 нм а также характерной сине-фиолетовой окраски. Наиболее высокие и стабильные значения оптической плотности наблюдаются при проведении реакции с температурным режимом 100 °С (за период 1-2 ч после начала реакции значение оптической плотности при длине волны 400 нм снизилось на 4 %). Проведение реакции выше 100 °С нецелесообразно т.к. образующийся продукт нестабилен во времени.
Таким образом, нами установлены оптимальные условия проведения реакции а-аминокислот с 0,2 % раствором нингидрина в ацетоне и на этом основании предлагается следующая методика анализа: к 2,5 мл 0,2 % раствора а-аминокислоты добавляют 0,5 мл 0,2 % раствора нингидрина в ацетоне и нагревают при температуре 100 °С в течение 15 мин (для лизина продолжительность реакции составляет 3-5 мин, т.к. более длительное нагревание приводит к разложению продукта реакции). После полного охлаждения продукт реакции разбавляют водой очищенной и спустя 1 ч после начала реакции определяют значение оптической плотности в диапазонах длин волн 399-402 нм на спектрофотометре в кюветах с толщиной поглощающего слоя 10 мм.
Данные условия проведения реакции мы использовали для большинства а-аминокислот, однако цистеин и тирозин вследствие их низкой растворимости в воде использовали в концентрации 0,04 % растворов по 2,5 мл.
С целью выявления подчинения закону светопоглощения продуктов реакции а-аминокислот с 0,2 % раствором нингидрина в ацетоне при длине волны 400 нм нами исследована зависимость светопоглощения от концентрации а-аминокислоты (рис. 9).
На рис. 9 приведен калибровочный график, который показывает, что продукт взаимодействия метионина с 0,2 % раствором нингидрина в ацетоне подчиняется закону светопоглощения при длине волны 400 нм в концентрациях от 0,005 до 0,02 мг/мл.
С целью установления аналитических возможностей оптимизированных условий нингидриновой реакции, нами проведен спектральный анализ раствора нингидрина в ацетоне после его нагревания при температуре 100 °С, без добавления раствора а-аминокислоты (табл. 5). Продукт реакции разбавляли водой до 100 мл.
Таблица 5. Спектральный анализ 0,2 % ацетонового раствора нингидрина
|
№ п/п |
Диапазон длин волн, нм |
Значения оптической плотности |
|
1 |
220-240 |
0,88340-0,82691 |
|
2 |
240-270 |
0,64921-0,59522 |
|
3 |
400-405 |
0,17690-0,16592 . |
|
4 |
560-570 |
0,13250-0,1100 |
Спектральный анализ показал, что раствор нингидрина в ацетоне имеет светопоглощение в тех же диапазонах длин волн, что и продукты его реакции с аминокислотами. Возможно, при нагревании происходит взаимодействие ацетона с нингидрином, и образуются продукты, которые поглощают в УФ- и видимой области спектров. Таким образом, ацетоновый раствор нингидрина может быть использован для количественного определения а-аминокислот только при условии сравнительного анализа спектральных данных продукта реакции анализируемой а-аминокислоты и раствора нингидрина, что существенно усложняет проведение анализа. Кроме того, ацетон является летучим, токсичным и пожароопасным растворителем, что ограничивает его использование.
На этом основании нами изучены продукты нингидриновой реакции в нелетучем растворителе - диметилсульфоксиде (ДМСО).
Исследование реакции а-аминокислот с 0,2 % раствором нингидрина в диметилсульфоксиде[править | править код]
В следующей серии экспериментов в качестве растворителя для нингидрина мы использовали диметилсульфоксид (ДМСО). Растворы нингидрина в ДМСО часто используют для количественного определения аминокислот с помощью аминокислотных анализаторов [1]. Важно отметить, что ДМСО имеет преимущества по сравнению с ацетоном: данный растворитель нелетучий, имеет невысокую токсичность, взрыво- и пожаробезопасен, что обеспечивает удобство его использования.
В экспериментах, на основании ранее оптимизированных условий реакции, мы использовали 0,2 % раствор нингидрина в ДМСО.
Нами исследованы спектры поглощения продуктов реакции 20-ти а-аминокислот с 0,2 % раствором нингидрина в ДМСО в диапазонах длин волн 220-600 нм. Реакцию проводили в течение 15 мин при температуре 100 °С по методике, которую мы оптимизировали для проведения реакции с раствором нингидрина в ацетоне (см. раздел 1.2.). После полного охлаждения продукты нингидриновой реакции каждой из 20-ти си-аминокислот разбавляли водой в различных соотношениях до получения значений оптической плотности максимумов поглощения от 0,4 до 1,0. Нами установлены три максимума поглощения при 250, 400 и 560-570 нм. Данная закономерность наблюдается для 18-ти из 20-ти а-аминокислот. Исключение составили продукты нингидриновой реакции с триптофаном и пролином, что объясняется особенностями структуры данных а-аминокислот. Продукт нингидриновой реакции триптофана в УФ-области имеет максимум поглощения при 272 нм, в видимой области спектра максимумы поглощений аналогичны другим а-аминокислотам. Продукт реакции раствора нингидрина в ДМСО с пролином окрашен в жёлтый цвет и имеет два максимума поглощения при длинах волн 300 и 340 нм, в видимой области спектра максимумы поглощения отсутствуют, однако имеется четкое плечо в широком диапазоне длин волн 520-600 нм, с достаточно интенсивным поглощением. Важно отметить, что продукты реакции большинства а-аминокислот имеют единые максимумы поглощения при 250 нм и 400 нм.
По аналогии с ацетоновым раствором нингидрина, нами изучена зависимость светопоглощения продукта реакции с 0,2 % раствором нингидрина в ДМСО от концентрации а-аминокислоты при длине волны 400 нм и установлено её подчинение закону светопоглощения Бугера - Ламберта - Бера (рис. 10).
На рис. 10 приведен калибровочный график, который показывает, что продукт реакции глицина с 0,2 % раствором нингидрина в ДМСО при длине волны 400 нм подчиняется закону светопоглощения в концентрации глицина от 0,03 до 0,19 мг/мл.
Для выяснения аналитических возможностей реакции нами изучены спектральные характеристики 0,2 % раствора нингидрина в ДМСО в условиях ее проведения, где вместо раствора а-аминокислоты добавляли равное количество воды. После полного охлаждения продукт реакции разбавляли водой до 100 мл. (табл. 6).
Таблица 6. Спектральный анализ 0,2 % раствора нингидрина в ДМСО
|
№ п/п |
Длина волны, нм |
Значение оптической плотности |
|
1 |
250 |
0,86921 |
|
3 |
400 |
0,18491 |
|
4 |
560-570 |
0,20470 |
Спектральный анализ показал, что раствор нингидрина в ДМСО, также как и в ацетоне поглощает в тех же диапазонах, в которых имеют поглощение и продукты его реакции с а аминокислотами, что существенно усложняет проведение анализа.
Исследование реакции а-аминокислот с 0,2 % водным раствором нингидрина[править | править код]
Для качественного и количественного анализа а-аминокислот достаточно часто используют водный раствор нингидрина [7, 13, 20]. На этом основании нами исследованы спектральные характеристики 0,2 % водного раствора нингидрина после его нагревания при температуре 100 °С в течение 15 мин и установлено, что водный раствор нингидрина имеет интенсивное поглощение в диапазоне длин волн 220-300 нм, но совершенно не поглощает в диапазоне длин волн от 400 до 600 нм (рис. 11).
Учитывая, что вода является наиболее доступным и безопасным растворителем, наиболее целесообразно проводить спектрофотометрическое исследование продуктов реакции с 0,2 % водным раствором нингидрина в видимой области спектра в диапазоне длин волн - от 400 до 600 нм.
Изучение спектральных характеристик продуктов реакции а-аминокислот с 0,2 % водным раствором нингидрина[править | править код]
Нами проведена нингидриновая реакция с 0,2 % водным раствором нингидрина по методике, указанной в ФСП на кислоту глутаминовую [10]. После полного охлаждения продукты нингидриновой реакции каждой из 20-ти а-аминокислот разбавляли водой в различных соотношениях до получения значений оптической плотности максимумов поглощения от 0,4 до 1,0. и изучали спектральные характеристики продуктов для 20-ти о-аминокислот в диапазоне длин волн 380-600 нм. Было установлено, что спектры поглощения имеют единый максимум при длине волны 400±2 нм и в диапазоне длин волн 550-560 нм.
Исключение составляют продукты реакции с цистеином, пролином и гистидином. Продукт реакции с цистеином характеризуется низкой интенсивностью поглощения в видимой области и имеет максимум при длине волны 450 нм. Пролин -единственная о-аминокислота, в структуре которой отсутствует первичная аминогруппа, этим объясняется отсутствие характерного (при 400 нм) максимума поглощения в видимой области спектра. Однако в диапазоне 395-402 нм отмечается четкое плечо с достаточно интенсивным поглощением. Продукт реакции с гистидином имеет недостаточную интенсивность поглощения в видимой области спектра. Важно отметить, что большинство продуктов реакции характеризуются единым максимумом поглощения при 400 нм (рис. 12-15).
Таким образом, наиболее целесообразно проводить реакцию с использованием водного раствора нингидрина с последующим определением оптической плотности её продукта при длине волны 400 нм.
Оптимизация условий проведения реакции a-аминокислот с ОД % водным раствором нингидрина[править | править код]
Нами изучено влияние важнейших факторов (соотношение компонентов реакции, продолжительность и температурный режим) на стабильность и значение оптической плотности при длине волны 400 нм продуктов взаимодействия a-аминокислот с водным раствором нингидрина. Для анализа мы использовали глицин.
При проведении реакции в условиях, указанных в ФСП на кислоту глутаминовую [10], нами установлено, что продукт реакции характеризуется низкой стабильностью значения оптической плотности при длине волны 400 нм во времени.
Поэтому, мы провели оптимизацию количественных соотношений между компонентами. Реакцию проводили при температуре 100 °С в течение 15 мин.
Продукты, после полного охлаждения, разбавляли водой (табл. 7).
Таблица 7. Оптимизация количественных соотношений компонентов реакции
|
№ п/п |
Количественные соотношения между компонентами реакции |
Разведени е |
Оптическая плотность продукта при λ=400 нм | |||
|
Навеска глицина, г |
Объем раствора глицина, мл |
Объем 0,2 % водного раствора нингидрина, мл |
продукта реакции водой |
Через 1 ч после начала реакции |
Снижение значения за период 1-2 ч после начала реакции, % | |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
1 |
0,02 |
1 |
1 |
До 50 мл |
0,61047 |
19 |
|
2 |
0,01 |
1 |
1 |
до 100 мл |
0,33356 |
15 |
|
3 |
0,005 |
1 |
1 |
до 100 мл |
0,34825 |
11 |
|
4 |
0,0025 |
1 |
1 |
до 100 мл |
0,36545 |
7 |
|
5 |
0,001 |
1 |
1 |
до 100 мл |
0,36835 |
2 |
|
6 |
0,0005 |
1 |
1 |
до 50 мл |
0,36156 |
6 |
|
7 |
0,001 |
1,25 |
1 |
до 100 мл |
0,33295 |
5 |
|
8 |
0,001 |
0,75 |
1 |
до 100 мл |
0,37382 |
6 |
|
9 |
0,001 |
1 |
0,9 |
до 100 мл |
0,34526 |
9 |
|
10 |
0,001 |
1 |
1Д |
до 100 мл |
0,38110 |
1 |
|
11 |
0,001 |
1 |
1,2 |
до 100 мл |
0,38474 |
5 |
|
12 |
0,001 |
1 |
1,3 |
до 100 мл |
0,38557 |
7 |
Из данных таблицы видно, что наиболее стабильный продукт во времени наблюдается при проведении реакции между 1 мл 0,1 % раствором глицина и 1,1 мл 0,2 % водного раствора нингидрина (значение оптической плотности за период времени 1-2 ч после начала реакции снижается на 1 %).
Нами также изучено влияние температуры, и продолжительности реакции во времени на стабильность продуктов (табл. 8).
Таблица 8. Оптимизация температурного режима и продолжительности реакции
|
№ п/п |
Температурный режим реакции, °С |
Продолжительность проведения реакции, мин |
Разведение продукта реакции водой |
Оптическая плотность продукта при λ=400 нм | |
|
Через 1 ч после начала реакции |
Снижение значения за период 1-2 ч после начала реакции, % | ||||
|
1 |
80 |
15 |
До 100 мл |
0,33638 |
5 |
|
2 |
90 |
15 |
До 100 мл |
0,36167 |
2,5 |
|
3 |
100 |
15 |
До 100 мл |
0,38110 |
1 |
|
4 |
110 |
15 |
До 100 мл |
0,39667 |
1 |
|
5 |
120 |
15 |
До 100 мл |
0,41112 |
1 |
|
6 |
130 |
15 |
До 100 мл |
0,37312 |
4 |
|
7 |
120 |
25 |
До 100 мл |
0,35289 |
5 |
|
8 |
120 |
22,5 |
До 100 мл |
0,43140 |
2,5 |
|
9 |
120 |
20 |
До 100 мл |
0,45056 |
0,5 |
|
10 |
120 |
17,5 |
До 100 мл |
0,43273 |
1 |
|
11 |
120 |
12,5 |
До 100 мл |
0,40105 |
3 |
|
8 |
120 |
10 |
До 100 мл |
0,38908 |
2 |
|
9 |
120 |
7,5 |
До 100 мл |
0,34934 |
5 |
Анализ данных таблицы показывает, что наиболее стабильные и высокие значения оптической плотности наблюдаются при проведении реакции в течение 20 мин при температуре 120 ^С. Следует отметить, что период времени 1-1,5 ч после начала реакции характеризуется максимальной стабильностью продукта: значение D остается постоянным с точностью до 0,001. При использовании растворов нингидрина в ацетоне и ДМСО стабильность продуктов реакции значительно ниже. Кроме того, как было описано выше, сам нингидрин в ацетоновом растворе и в растворе ДМСО имеет светопоглощение в тех же диапазонах, что и продукты его реакции с а-аминокислотами. Учитывая доступность и безопасность, вода является наиболее рациональным растворителем для приготовления нингидринового реактива.
С целью изучения возможности взаимодействия нингидрина с водой, нами изучены спектральные характеристики 0,2 % водного раствора нингидрина в оптимизированных условиях проведения нингидриновой реакции (при температуре 120 °С в течение 20 мин), однако вместо раствора а-аминокислоты мы добавили равное количество воды. Установлено, что исследуемый раствор не поглощает в диапазоне длин волн 350-600 нм, в то время как продукты реакции а-аминокислот с водным раствором нингидрина имеют четкий максимум поглощения именно при 400±2 нм, что позволяет использовать эту длину волны для количественной оценки а-аминокислот.
Таким образом, на примере глицина нами установлены оптимальные условия проведения нингидриновой реакции: к 1 мл 0,1 % раствора а-аминокислоты добавляют 1,1 мл 0,2 % водного раствора нингидрина и нагревают при температуре 120 °С в течение 20 мин. После полного охлаждения продукт реакции разбавляют водой до 100 мл и спустя 1 ч после начала реакции на спектрофотометре определяют значение оптической плотности при длине волны 400 нм в кюветах с толщиной поглощающего слоя 10 мм.
Нами установлено, что указанные выше условия проведения нингидриновой реакции являются наиболее оптимальными для большинства а-аминокислот.
Исключение составили следующие а-аминокислоты: цистеин, тирозин, аспарагиновая кислота и лизин. Цистеин и тирозин, вследствие их низкой растворимости в воде, мы использовали в виде менее концентрированных 0,04 % растворов, увеличив их объёмы до 2,5 мл. При этом 0,2 % водный раствор нингидрина добавляли в эквимолярных количествах по отношению к указанным о-аминокислотам: 0,7 мл - к 2,5 мл 0,04 % раствора цистеина и 0,5 мл - к 2,5 мл 0,04 % раствора тирозина.
Продукты реакции аспарагиновой кислоты и лизина с 0,2 % водным раствором нингидрина отличаются невысокими значениями оптической плотности при длине волны 400 нм. Аспарагиновая кислота — дикарбоновая а-аминокислота, лизин - а-аминокислота содержащая в радикале первичную аминогруппу. По-видимому, за счёт наличия в указанных аминокислотах дополнительных карбоксильной и аминогрупп изменяется pH реакционной среды, что приводит к частичному разложению продуктов реакции. На этом основании мы увеличили объёмы реагентов в 2 раза, т.е. по 2,2 мл 0,2 % водного раствора нингидрина добавляли к 2 мл 0,1 % растворам аспарагиновой кислоты и лизина. Кроме того, для лизина, вследствие нестойкости продукта его реакции с нингидрином, оптимальная продолжительность нагревания составляет 2 мин. Спектры продуктов взаимодействия нингидрина с данными а-аминокислотами снимают на спектрофотометре без предварительного разведения.
На основании оптимизированных условий проведения реакции а-аминокислот с 0,2 % водным раствором нингидрина нами была изучена зависимость светопоглощения продукта реакции от концентрации о-аминокислоты при длине волны 400 нм (рис. 16).
На рис. 16 приведен калибровочный график, который показывает, что продукт взаимодействия глицина с 0,2 % водным раствором нингидрина подчиняется закону светопоглощения в концентрации от 0,005 до 0,025 мг/мл.
Заключение[править | править код]
Таким образом, на основании исследования спектральных характеристик продуктов реакции а-аминокислот с нингидрином в различных растворителях установлены единые максимумы поглощения для большинства а-аминокислот: в УФ- (в диапазоне длин волн 220-260 нм) и видимой областях спектра (при длине волны 400±2 нм, а также в диапазоне длин волн 560-570 нм).
Оптимизация условий проведения нингидриновой реакции показала, что продукты реакции а-аминокислот с водным раствором нингидрина характеризуются наибольшей стабильностью во времени и имеют единый максимум поглощения при длине волны 400±2 нм. Поэтому, наиболее целесообразно проводить нингидриновую реакцию с водным раствором нингидрина, с последующим спектрофотометрическим определением продуктов при длине волны 400 нм.
На этом основании разработаны методы количественного определения а-аминокислот в лекарственных препаратах и растительном сырье, основанные на реакции с 0,2 % водным раствором нингидрина. Разработанные методы отличаются достаточной точностью (относительная ошибка результата отдельного определения для всех образцов не превышает ±3 %) и доступностью.
Читайте также[править | править код]
- Количественное определение глицина в таблетках
- Количественное определение белка в продуктах
- Допинг-контроль: методы и тесты
Список литературы[править | править код]
1. Аминокислотный и минеральный состав надземной части Atragene Speciosa / И.В. Шилова, Е.А. Краснов, Н.В. Барановская и др. // Хим.-фарм. журн. - 2002.
2. Аникина Н.В. Спектрофотометрическое определение цистина / Н.В. Аникина, М.Е. Пудель // Хим.-фарм. журн. -1983. - Т. 17, №2.- С.244-245.
3. Бондаренко Б.Н. Количественное определение аминокислот при хроматографии в тонком слое / Б.Н. Бондаренко // Лаб. дело. —1984. - №2. — С. 118-120.
4. Бородина B.JI. Экспресс-метод количественного определения аминокислот с помощью газожидкостной хроматографии / B.J1. Бородина, А.И. Крылов, В.А. Рогозкин // Лаб. дело. —1984.— №7. — С. 395—397.
5. Великанова О.Ф. Спектрофотометрический метод определения суммарного количества аминокислот в сыворотке крови / О.Ф. Великанова, Ю.В. Галаев // Лаб. дело. - 1981. - № 11. - С. 701-702.
6. Глицин таблетки сублингвальные 0,1 г.: ФСП 42-0025265-02-99. — 07.06.2002.
7. Государственная фармакопея СССР. — XI - изд. — М.: Медицина, 1989. - Вып 2. -400 с.
8. Доссон Р. Справочник биохимика / Р. Доссон, Д. Эллиот - М.: Мир, 1991. - 544 -С.
9. Изучение аминокислотной фракции экстракта мумие сухого / ТЛ. Киселева, Л.Н. Фролова, ЛА. Баратова и др. // Хим.-фарм. журн. - 1998. - Т. 32, № 2. - С. 47-51.
10. Кислота глютаминовая: ВФС 42-2722-96. - 25.04.96.
11. Количественное определение аминокислот в пыльце (обножке) / И.В. Духанина,А.Ю. Айрапетова, Г.Д. Лазарян. и др. // Хим.-фарм. журн. - 2006. - Т. 40, № 2. -С. 22-23.
12. Колориметрические методы анализа азотистых соединений: Метод, реком / Волгогр. сельхоз. ин-т, кафедра химии; Сост. В.А. Храмов. - Волгоград, 1979.- 15 с.
13. Копытко Я.Ф. Аминокислоты и жирные кислоты настоек Парнасия (Белозора болотного) гомеопатических матричных / Я.Ф. Копытко // Хим.-фарм. журн. -2003. -Т. 37, № 7.
14. Крищенко В.П. Комплексная методика определения аминокислот в различных фракциях азотного комплекса растений / В.П. Крищенко // Изв. АН СССР. Сер. Биология. - 1978. - № 3! - С. 327-331.
15. Лазарян Д.С. Сравнительное изучение аминокислотного состава расплода пчел / Д.С. Лазарян // Хим.-фарм. журн. - 2002. - Т. 36, № 12. - С. 42-44.
16. Мансурова И.Д. Определение количества оксилизина и лизина в сыворотке крови / Й.Д. Мансурова, Е.Н. Набиджанова // Лаб. дело. - 1982. - № 8. - С. 459-461.
17. Методы биохимического исследования растений / Под ред. А.И. Ермаковой. -Л : Химия, 1977.-540 с.
18. Половодова Н.В. Разработка спектрофотометрической методики определения кислоты аспарагиновой на основе реакции с нингидрином / Н.В. Половодова // Молодежная наука Прикамье - 2002: Тез. докл. Обл. науч. конф. молодых ученых, студентов и аспирантов, Пермь, 6-9 декабря 2002 г. - Пермь, 2002.- С. 162.
19. Россихина А.В. Разработка способа определения калия аспарагината в препарате «Аспаркам» / А.В. Россихина // Молодежная наука Прикамье - 2002: Тез. докл. Обл. науч. конф. молодых ученых, студентов и аспирантов, Пермь, 6-9 декабря 2002 г. - Пермь, 2002. - С. 163.
20. Стандартизация рогов и пантов северного оленя. 1. Количественное определение нингидринактивных веществ в порошке рогов северного оленя /В.П. Пахомов, Т.В. Максимова, И.Н. Никулина и др. // Хим.-фарм. журн. - 1997. -Т. 31,№4.-С. 53-54.
21. Тихонов Б.Б. Применение метода капиллярного электрофореза для исследования аминокислотного состава белков амаранта / Б.Б. Тихонов П Вестн. Тверск. гос. техн. ун-та. - 2002. - № 2. - С. 128-130.
22. УФ-спектрофотометрическое определение ароматических аминокислот / Е.Р. Рошаль, В.Н. Сенаторова, А.Ф. Шолин и др. // Хим.-фарм. журн. - 1991. - Т. 25,№4.-С. 80-83.
23. Химия биологически активных и природных соединений / Под ред. Н.А. Преображенского, Р.П. Евстигнеевой. - М.: Химия, 1970. - 512 с.
24. Цистеин: ВФС 42-2633-96. - 20.02.96.
25. Chen Bing. Одновременное определение аминокислот в пищевых продуктах методом капиллярного электрофореза при косвенном детектировании в УФ-лучах / Chen Bing , Li Xiaoge, He Ping // Chin. J. Chromatogr. - 2004. - VOL. 22, № 1.-P. 74-76.
26. Fu Min. Определение следовых количеств аминокислот нейротрансмиттеров в плазме крови крыс методом капиллярного электрофореза в сочетании с детектированием флуоресценции, индуцированной диодным лазером / Fu Min, Zhang Dongming, Ma Wanyan // Chin. J. Anal. Chem. - 2003. - VOL. 31, № 3. - P. 296-299.
27. Garcia-Willar N. Liquid chromatographic determination of lysine by potentiometric detection with biosensor / N. Garcia-Willar, Hemandes-Cassou // Anal. Lett. -2002.-№8.-P. 1313-1323.
28. Gatte R. Phanquenone: a useful fluorescent pre-chromatographic derivatization reagent for liquid chromatographic analyses of aminoacid dosage form / R. Gatte, M.G. Gioia, A.M. Di Pieta // Anal. chem. acta. - 2002. - № 1-2. - P. 11-20.
29. Khan A.A. Studies of the kinetics and mechanism of interaction of ot-aminoacids with ninhydrin // J. Indian Chem. Soc. - 1989. - VOL. 66, № 7. - P. 454-456.
30. Kuryt T. Quantitative analysis of amino acids in biological fluids by gas chromatography with flame ionization detection / T. Kuryt, D. Sawnor-Corszynska // Acta chromatogr. - 2000. - № 10. - P. 97-103.
31. Yu Hong. Определение аминокислот и глюкозы в аминокислотных инъекционных растворах методом анионообменной хроматографии с интегрированным импульсным амперометрическим детектированием