BCAA: научный обзор — различия между версиями
Krash (обсуждение | вклад) |
Krash (обсуждение | вклад) |
||
| Строка 219: | Строка 219: | ||
Суммарно, 6 аминокислот принимает участие в образовании энергии в мышечной ткани: аланин, аспартат, глутамат и три ВСАА (S.Sowers, 2009), но роль ВСАА наиболее велика. Мышечная ткань содержит 60% специфических ферментов, необходимых для окисления аминокислот с целью получения энергии, особенно ВСАА. В процессе тренировок организм использует ВСАА как источник энергии. Чем интенсивнее и продолжительнее нагрузки, тем в большей мерее используются ВСАА. Установлено, что от 3% до 18% всей рабочей энергии обеспечивают ВСАА, но эта доля может значительно меняться в зависимости от характера тренировочной нагрузки. Особенно высока потребность в лейцине. Доля свободного (легко доступного для получения энергии) лейцина в общем пуле свободных аминокислот в 25 раз выше других. Мышц это касается особенно, поскольку пул свободных аминокислот в скелетных мышцах – 75%. ВСАА также могут конвертироваться в мышцах в L-аланин или L-глутамин. Две последних аминокислоты в процессе гликонеогенеза в печени могут превращаться в глюкозу. Лейцин также непосредственно стимулирует синтез протеинов за счет своей сигнальной роли (увеличивает поступление аминокислот внутрь клеток). BCAA при приеме в виде свободных аминокислот разделяется на фракцию, идущую в печень и кишечник, а также фракцию, поступающую прямо в кровоток. Пищевые добавки ВСАА в свободной форме быстро повышают концентрацию этих незаменимых аминокислот в плазме крови. Этот факт надо помнить, когда спортивный врач рассчитывает время, дозу и форму подачи ВСАА в организм с определенной тренировочной задачей: ВСАА в связанной форме (в составе диеты или в составе WP) обеспечит относительно медленное, но длительное поступление ВСАА в мышцы; ВСАА в чистом виде – быстрое, но кратковременное анаболическое действие. Роль этого фактора становится особенно важной при снижении запасов гликогена в мышцах и/или при ограничении поступления углеводов в организм в целом (например, низкоуглеводная диета). Пищевые добавки BCAA эффективны как при приеме до, так и после тренировок. Хотя роли лейцина отводится ведущее место в этих процессах, большинство экспертов считает прием данной аминокислоты в составе комплекса ВСАА более эффективным. | Суммарно, 6 аминокислот принимает участие в образовании энергии в мышечной ткани: аланин, аспартат, глутамат и три ВСАА (S.Sowers, 2009), но роль ВСАА наиболее велика. Мышечная ткань содержит 60% специфических ферментов, необходимых для окисления аминокислот с целью получения энергии, особенно ВСАА. В процессе тренировок организм использует ВСАА как источник энергии. Чем интенсивнее и продолжительнее нагрузки, тем в большей мерее используются ВСАА. Установлено, что от 3% до 18% всей рабочей энергии обеспечивают ВСАА, но эта доля может значительно меняться в зависимости от характера тренировочной нагрузки. Особенно высока потребность в лейцине. Доля свободного (легко доступного для получения энергии) лейцина в общем пуле свободных аминокислот в 25 раз выше других. Мышц это касается особенно, поскольку пул свободных аминокислот в скелетных мышцах – 75%. ВСАА также могут конвертироваться в мышцах в L-аланин или L-глутамин. Две последних аминокислоты в процессе гликонеогенеза в печени могут превращаться в глюкозу. Лейцин также непосредственно стимулирует синтез протеинов за счет своей сигнальной роли (увеличивает поступление аминокислот внутрь клеток). BCAA при приеме в виде свободных аминокислот разделяется на фракцию, идущую в печень и кишечник, а также фракцию, поступающую прямо в кровоток. Пищевые добавки ВСАА в свободной форме быстро повышают концентрацию этих незаменимых аминокислот в плазме крови. Этот факт надо помнить, когда спортивный врач рассчитывает время, дозу и форму подачи ВСАА в организм с определенной тренировочной задачей: ВСАА в связанной форме (в составе диеты или в составе WP) обеспечит относительно медленное, но длительное поступление ВСАА в мышцы; ВСАА в чистом виде – быстрое, но кратковременное анаболическое действие. Роль этого фактора становится особенно важной при снижении запасов гликогена в мышцах и/или при ограничении поступления углеводов в организм в целом (например, низкоуглеводная диета). Пищевые добавки BCAA эффективны как при приеме до, так и после тренировок. Хотя роли лейцина отводится ведущее место в этих процессах, большинство экспертов считает прием данной аминокислоты в составе комплекса ВСАА более эффективным. | ||
| − | + | {{ВСАА|3=3}} | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | { | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
== Читайте также == | == Читайте также == | ||
| + | *[[Исследования эффектов BCAA]] | ||
| + | *[[Прием BCAA]] | ||
| + | *[[BCAA и тренировки]] | ||
*[[L-карнитин: вред и побочные эффекты]] | *[[L-карнитин: вред и побочные эффекты]] | ||
*[[Карнитин (медицинское применение)]] | *[[Карнитин (медицинское применение)]] | ||
| Строка 344: | Строка 244: | ||
*Almeida C.C., Alvares T.S., Costa M.P., C.A.Conte-Junior. Protein and Amino Acid Profiles of Different Whey Protein Supplements. J.Dietary Suppl., 2015, 3:1-11. | *Almeida C.C., Alvares T.S., Costa M.P., C.A.Conte-Junior. Protein and Amino Acid Profiles of Different Whey Protein Supplements. J.Dietary Suppl., 2015, 3:1-11. | ||
*Bassit R.A., Sawada L.A., Bacurau R.F. et al. Branched-chain amino acid supplementation and the immune response of long-distance athletes. Nutrition, 2002,18(5):376-379. | *Bassit R.A., Sawada L.A., Bacurau R.F. et al. Branched-chain amino acid supplementation and the immune response of long-distance athletes. Nutrition, 2002,18(5):376-379. | ||
| − | |||
*Blomstrand E., Andersson S., Hassmen P. et al. Effect of branched-chain amino acid and carbohydrate supplementation on the exercise-induced change in plasma and muscle concentration of amino acids in human subjects. Acta Physiol.Scand., 1995, 153:87–96. | *Blomstrand E., Andersson S., Hassmen P. et al. Effect of branched-chain amino acid and carbohydrate supplementation on the exercise-induced change in plasma and muscle concentration of amino acids in human subjects. Acta Physiol.Scand., 1995, 153:87–96. | ||
| − | |||
*Blomstrand E., Essen-Gustavsson B. Changes in amino acid concentration in plasma and type I and type II fibers during resistance exercise and recovery in human subjects. Amino Acids, 2009, 37: 629-636. | *Blomstrand E., Essen-Gustavsson B. Changes in amino acid concentration in plasma and type I and type II fibers during resistance exercise and recovery in human subjects. Amino Acids, 2009, 37: 629-636. | ||
*Brosnan J.T., Brosnan M.E. Branched-Chain Amino Acids: Enzyme and Substrate Regulation. J.Nutr., 2006, 136: 207S–211S. | *Brosnan J.T., Brosnan M.E. Branched-Chain Amino Acids: Enzyme and Substrate Regulation. J.Nutr., 2006, 136: 207S–211S. | ||
*Burke L. M. branched-Chain Amino Acids (BCAAs) and Athletic Performance. International Sports Medicine Journal, 2001, 2 (3). | *Burke L. M. branched-Chain Amino Acids (BCAAs) and Athletic Performance. International Sports Medicine Journal, 2001, 2 (3). | ||
*Campbell B., Kreider R.B., Ziegenfuss T. et al. International Society of Sports Nutrition position stand: protein and exercise. J.Int.Soc.Sports Nutr., 2007, 4:8. | *Campbell B., Kreider R.B., Ziegenfuss T. et al. International Society of Sports Nutrition position stand: protein and exercise. J.Int.Soc.Sports Nutr., 2007, 4:8. | ||
| − | |||
*Consumer Lab. Protein powders and drinks review—for body building, sports & dieting. 2014. Accessed Jun. 21, 2014. | *Consumer Lab. Protein powders and drinks review—for body building, sports & dieting. 2014. Accessed Jun. 21, 2014. | ||
*ConsumerReport.org. Consumer Reports Magazine. How much protein? 2010. Accessed Jun. 23, 2014. | *ConsumerReport.org. Consumer Reports Magazine. How much protein? 2010. Accessed Jun. 23, 2014. | ||
| Строка 358: | Строка 255: | ||
*Cynober L.C., Harris R. A. Symposium on Branched-Chain amino acids: Conference summery. J.Nutrition, 2006, 136: 333-336. | *Cynober L.C., Harris R. A. Symposium on Branched-Chain amino acids: Conference summery. J.Nutrition, 2006, 136: 333-336. | ||
*da Luz C.R., Nicastro H., Zanchi N.E. Potential therapeutic effects of branched-chain amino acids supplementation on resistance exercise-based muscle damage in humans. J.Intern.Soc. Sports Nutr., 2011, 8:23. | *da Luz C.R., Nicastro H., Zanchi N.E. Potential therapeutic effects of branched-chain amino acids supplementation on resistance exercise-based muscle damage in humans. J.Intern.Soc. Sports Nutr., 2011, 8:23. | ||
| − | |||
*Dietary Reference Intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids (Macronutrients) (2005) National Academy of Sciences. Institute of Medicine. Food and Nutrition Board. | *Dietary Reference Intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids (Macronutrients) (2005) National Academy of Sciences. Institute of Medicine. Food and Nutrition Board. | ||
| − | |||
*Farnfield M.M., Trenerry C., Carey K.A., Cameron-Smith D. Plasma amino acid response after ingestion of different whey protein fractions. Intern.J.Food Sci.Nutr., 2009, 60(6):476-486. | *Farnfield M.M., Trenerry C., Carey K.A., Cameron-Smith D. Plasma amino acid response after ingestion of different whey protein fractions. Intern.J.Food Sci.Nutr., 2009, 60(6):476-486. | ||
*Garlick P.J., Grant I. Amino acid infusion increases the sensitivity of muscle protein synthesis in vivo to insulin. Effect of branched-chain amino acids. Biochem J., 1988, 254(2):579-584. | *Garlick P.J., Grant I. Amino acid infusion increases the sensitivity of muscle protein synthesis in vivo to insulin. Effect of branched-chain amino acids. Biochem J., 1988, 254(2):579-584. | ||
| Строка 369: | Строка 264: | ||
*Hefler S.K.,Wildman L., Gaesser G.A. et al. Branched-chain amino acid (BCAA) supplementation improves endurance performance in competitive cyclists. Medicine and Science in Sports and Exercise, 1993, 25, S24 (abstract). | *Hefler S.K.,Wildman L., Gaesser G.A. et al. Branched-chain amino acid (BCAA) supplementation improves endurance performance in competitive cyclists. Medicine and Science in Sports and Exercise, 1993, 25, S24 (abstract). | ||
*Howatson G., van Someren K.A. The prevention and treatment of exerciseinduced muscle damage. Sports Med., 2008, 38(6):483-503. | *Howatson G., van Someren K.A. The prevention and treatment of exerciseinduced muscle damage. Sports Med., 2008, 38(6):483-503. | ||
| − | |||
*Hutson S.M., Sweatt A.J., Lanoue K.F. Branched-chain [corrected] amino acid metabolism: implications for establishing safe intakes. J.Nutr., 2005, 135(6 Suppl):1557S-1564S. | *Hutson S.M., Sweatt A.J., Lanoue K.F. Branched-chain [corrected] amino acid metabolism: implications for establishing safe intakes. J.Nutr., 2005, 135(6 Suppl):1557S-1564S. | ||
*Jackman S.R., Witard O.C., Jeukendrup A.E., Tipton K.D. Branched-chain amino acid ingestion can ameliorate soreness from eccentric exercise. Med.Sci.Sports Exerc., 2010, 42(5):962-970. | *Jackman S.R., Witard O.C., Jeukendrup A.E., Tipton K.D. Branched-chain amino acid ingestion can ameliorate soreness from eccentric exercise. Med.Sci.Sports Exerc., 2010, 42(5):962-970. | ||
| Строка 375: | Строка 269: | ||
*Karlsson H.K., Nilsson P.-A., Nilsson J. et al. Branched-Chain amino acids increase p70s6k phophoralation in human skeletal muscle after resistance exercise. American Journal of Physiology Endocrinolgy and Metabolism, 2004, 287: 1-7. | *Karlsson H.K., Nilsson P.-A., Nilsson J. et al. Branched-Chain amino acids increase p70s6k phophoralation in human skeletal muscle after resistance exercise. American Journal of Physiology Endocrinolgy and Metabolism, 2004, 287: 1-7. | ||
*Koba T., Hamada K., Sakurai M. et al. Branched-chain amino acids supplementation attenuates the accumulation of blood lactate dehydrogenase during distance running. J.Sports Med.Phys.Fitness, 2007, 47:316–322. | *Koba T., Hamada K., Sakurai M. et al. Branched-chain amino acids supplementation attenuates the accumulation of blood lactate dehydrogenase during distance running. J.Sports Med.Phys.Fitness, 2007, 47:316–322. | ||
| − | |||
*Kreider R.B., Wilborn C.D., Taylor L. et al. ISSN exercise & sport nutrition review: research and recommendations. J.Intern.Soc.Sports Nutr., 2010, 7:7-50. | *Kreider R.B., Wilborn C.D., Taylor L. et al. ISSN exercise & sport nutrition review: research and recommendations. J.Intern.Soc.Sports Nutr., 2010, 7:7-50. | ||
| − | |||
| − | |||
*Mayers J.R., Torrence M.E., Fiske B.P. Analysis of Whole-Body Branched-Chain Amino Acid Metabolism in Mice Utilizing 20% Leucine 13C6 and 20% Valine 13C5 Mouse Feed. Cambridge Isotope Laboratories, Inc. isotope.com, 2014. | *Mayers J.R., Torrence M.E., Fiske B.P. Analysis of Whole-Body Branched-Chain Amino Acid Metabolism in Mice Utilizing 20% Leucine 13C6 and 20% Valine 13C5 Mouse Feed. Cambridge Isotope Laboratories, Inc. isotope.com, 2014. | ||
| − | |||
*Mikulski T., Ziemba A.W., Chmura J. et al. The effect of supplementation with branched chain amino acids (BCAA) on psychomotor performance during graded exercise in human subjects. Biol Sport, 2002, 19: 295-301. | *Mikulski T., Ziemba A.W., Chmura J. et al. The effect of supplementation with branched chain amino acids (BCAA) on psychomotor performance during graded exercise in human subjects. Biol Sport, 2002, 19: 295-301. | ||
| − | |||
*Newsholme E.A.,Parry-Billings M., McAndrew M. et al Biochemical mechanism toexplain some characteristics of overtraining. In Brouns F (editor):Medical Sports Science, 1991, 32, Advances in Nutrition and Top Sport(pages 79-93). Basel, Germany: Karger. | *Newsholme E.A.,Parry-Billings M., McAndrew M. et al Biochemical mechanism toexplain some characteristics of overtraining. In Brouns F (editor):Medical Sports Science, 1991, 32, Advances in Nutrition and Top Sport(pages 79-93). Basel, Germany: Karger. | ||
| − | |||
| − | |||
*Nosaka K., Sacco P., Mawatari K. Effects of amino acid supplementation on muscle soreness and damage. Int.J.Sport Nutr.Exerc.Metab., 2006, 16(6):620-635. | *Nosaka K., Sacco P., Mawatari K. Effects of amino acid supplementation on muscle soreness and damage. Int.J.Sport Nutr.Exerc.Metab., 2006, 16(6):620-635. | ||
*Sharp C.P., Pearson D.R. Amino acid supplements and recovery from highintensity resistance training. J Strength Cond Res 2010, 24(4):1125-1130. | *Sharp C.P., Pearson D.R. Amino acid supplements and recovery from highintensity resistance training. J Strength Cond Res 2010, 24(4):1125-1130. | ||
| Строка 393: | Строка 280: | ||
*Sowers S. A Primer On Branched Chain Amino Acids. Huntington College of Health Sciences, 2009, 1-6. | *Sowers S. A Primer On Branched Chain Amino Acids. Huntington College of Health Sciences, 2009, 1-6. | ||
*Spillane M., Schwarz N., Willoughby D.S. Heavy resistance training and peri-exercise ingestion of a multi-ingredient ergogenic nutritional supplement in males; effects on body composition, muscle performance and markers of muscle protein synthesis. J.Sport Sci.Med., 2012, 13:894–903. | *Spillane M., Schwarz N., Willoughby D.S. Heavy resistance training and peri-exercise ingestion of a multi-ingredient ergogenic nutritional supplement in males; effects on body composition, muscle performance and markers of muscle protein synthesis. J.Sport Sci.Med., 2012, 13:894–903. | ||
| − | |||
| − | |||
| − | |||
| − | |||
*Wu G. Intestinal Mucosal Amino Acid Catabolism. . J. Nutr., 1998, 128: 1249–1252. | *Wu G. Intestinal Mucosal Amino Acid Catabolism. . J. Nutr., 1998, 128: 1249–1252. | ||
*Zanchi N.E., Nicastro H., Lancha A.H.Jr. Potential antiproteolytic effects of L-leucine: observations of in vitro and in vivo studies. Nutr.Metab. (Lond), 2008, 5:20. | *Zanchi N.E., Nicastro H., Lancha A.H.Jr. Potential antiproteolytic effects of L-leucine: observations of in vitro and in vivo studies. Nutr.Metab. (Lond), 2008, 5:20. | ||
[[Категория:Спортивное_питание]] | [[Категория:Спортивное_питание]] | ||
Версия 05:09, 5 марта 2020
Содержание
ВСАА в спортивной медицине
Авторы: д.м.н. Александр Дмитриев, врач-эндокринолог Алексей Калинчев
«Позиция Международного Общества Спортивного Питания (ISSN position stand) состоит в том, что BCAA даже при однократном приеме стимулируют синтез протеинов и ресинтез гликогена, отдаляют начало развития усталости, помогают поддерживать ментальные функции при аэробных физических нагрузках. ISSN делает заключение, что потребление BCAAs (в дополнение к углеводам) перед, в процессе и после тренировочных нагрузок рекомендуется как безопасное и эффективное» (B.Campbell и соавт., 2007; R.B.Kreider и соавт., 2010). Уровень доказательности «А» (наивысший). Однако, один из главных вопросов заключается в том, целесообразен ли дополнительный прием ВСАА в чистом виде, если поступление в организм этих незаменимых аминокислот в составе высококачественных белков (например, whey-протеинов) способно обеспечить потребность в покое и при физических нагрузках. Ряд экспертов считает, что дополнительный прием ВСАА (плюс к ВСАА-составляющей белков) целесообразен только в ситуациях очень интенсивных и пролонгированных физических нагрузок (см. в конце данного обзора), когда поступление ВСАА (особенно, лейцина) из высококачественных протеинов в рамках сбалансированной диеты недостаточно для покрытия потребности в незаменимых аминокислотах.
Ключевая роль ВСАА в синтезе мышечных белков впервые доказана в экспериментальной работе P.J.Garlick и I.Grant еще в 1988 году. Они показали равный эффект в отношении синтеза мышечного белка потребления всех незаменимых аминокислот вместе и ВСАА в отдельности.
ВСАА в составе белков как критерий качества протеина
Количественный состав ВСАА и их соотношение в белках – важный показатель для протеинов, применяющихся в спорте. С этой точки зрения, различные формы whey-протеина (WP) на сегодняшний день считаются оптимальными (подробнее в обзоре по протеинам в спорте). В то же время, дополнительное введение ВСАА в состав готовых форм протеинов из разных источников – современная стратегия производства (см. далее в обзоре), уравнивающая в той или иной степени такие формулы с WP.
Метаболизм ВСАА при поступлении в организм в составе белков
В процессе переваривания белков в ЖКТ они, как известно, расщепляются на большие белковые молекулы, которые затем в тонком кишечнике под воздействием протеаз панкреатического сока образуют менее длинные пептиды. По мере прохождения по тонкому кишечнику пептиды распадаются на «легкие» пептиды (несколько аминокислот в цепочке), а в финальной стадии переваривания под действием пептидаз – на отдельные аминокислоты. Аминокислоты и ряд «легких» пептидов активно абсорбируются в стенке кишечника специфическими транспортерами, циркулируют в кровяном русле и попадают в печень. Окисление ВСАА в печени приводит к образованию оксо-кето-кислот – специфической формы ВСАА. Это означает, что базовые ВСАА не подвергаются прямому метаболизму в печени. Наибольшой процент ВСАА окисляется в мышечной ткани, и небольшой – в жировой. Таким образом, ВСАА проявляют органоспецифические свойства в отношении скелетных мышц.
Метаболизм ВСАА при экзогенном пероральном поступлении в организм
Трансформация ВСАА в кишечнике
Уже при прохождении через ЖКТ (еще до поступления в кровоток) ВСАА включаются в метаболические процессы эпителия тонкого кишечника. Под влиянием двух типов трансаминаз и дегидрогеназы длинноцепочечных альфа-кетокислот, которые присутствуют в клетках слизистой оболочки тонкого кишечника, ВСАА включаются во внутриклеточные процессы обмена. В эксперименте показано, что около 30% от всего потребленного лейцина извлекается из кишечного содержимого во время первого прохождения пищи. Из этого количества 55% подвергается трансаминированию, а 45% идет на синтез белка. У человека 20-30% экзогенно введеного лейцина утилизируется кишечником во время первого прохождения (G.Wu, 1998). Такие же примерно цифры характеризуют снижение объемов изолейцина и валина, направляемые на всасывание и поступление в кровоток, из-за поглощения эндотелием ЖКТ (30-40% от принятого внутрь количества).
Абсорбция ВСАА в кишечнике
ВСАА могут поступать в организм в составе различных белков. Соответственно, их количество в белке, скорость высвобождения из них в процессе пищеварения во многом определяют динамику всасывания в кишечнике и поступление в циркуляторное русло. С другой стороны, когда речь идет о спортивном питании, источниками ВСАА являются гидролизаты, изоляты и концентраты протеинов (в первую очередь, whey-протеинов – WPH, WPI, WPC), а также другие трансформированные формы белков с их пептидами различной величины, и составы, где ВСАА представлены уже свободными аминокислотами. Соответственно, использование конкретного источника ВСАА предполагает знание фармакокинетики каждого конкретного продукта. Недопустимым является прямое сравнение ценности того или иного источника ВСАА только по их количественному содержанию в продукте, особенно, сопоставление с ВСАА в виде отдельного аминокислотного комплекса. Экзогенное поступление ВСАА в чистом виде (включая их добавки в белковые комплексы) уже имеет преимущество перед потреблением белка, поскольку переваривание белка и высвобождение из него ВСАА требует энергетического и субстратного (ферментного) обеспечения и времени. Кроме того, в процессе переваривания высвобождаются не только ВСАА, но и другие аминокислоты, которые для транспортных белков в стенке кишечника являются в определенной степени конкурентными продуктами. Транспортеры могут иметь неизбирательный характер.
Несколько ключевых моментов при оценке абсорбции ВСАА в составе белков: 1) ВСАА абсорбируются быстрее, чем аминокислоты с меньшей длиной цепи; 2) незаменимые аминокислоты абсорбируются быстрее, чем заменимые.
В работе M.M.Farnfield и соавторов (2009) прослежена динамика концентраций аминокислот в плазме человека после перорального приема различных фракций whey-протеина (WP). Это прямой индикатор поступления ВСАА, потребляемых в составе белков, позволяющий сравнивать разные белки для применения в спортивной и клинической медицине. WP в процессе производства фракционируются с образованием пептидов различного размера. Такие изменения состава WP могут оказывать влияние на скорость и объем абсорбции аминокислот в ЖКТ и, в конечном счете, изменять синтез белка в организме. В рутинной практике спортивных врачей принято описывать WP как «быстрый» (быстро всасывающийся) белок (подчеркивая «медленный» характер всасывания аминокислот казеина), однако точных данных о скорости поступления аминокислот (АК) из WP при применении его различных форм в большинстве работ не приводится. Поэтому целью работы M.M.Farnfield и соавторов была оценка аминокислотного «ответа» плазмы крови на пероральный прием нескольких наиболее популярных форм WP: b-лактоглобулин-обогащенного WP (BLG), whey-протеина изолята (WPI) и гидролизованного whey-протеина изолята (H-WPI). Фармакокинетическое исследование выполнено на 8 здоровых взрослых субъектах (4 женщины и 4 мужчин, средний возраст 27 лет, вес 72 кг, рост170 см, индекс массы тела ИМТ – 23,2 кг/см2). Как видно из таблицы 1, аминокислотный состав потребляемых белковых смесей по суммарному показателю ВСАА был практически идентичен, как и по изолейцину и валину. Небольшое превышение концентрации лейцина (около 10%) над его концентрацией в других смесях отмечено у BLG.
Таблица 1. Аминокислотный состав исследуемых форм WP (M.M.Farnfield и соавт.,2009). Объяснения в тексте.
|
Аминокислоты г/500 г |
Напиток | |||
|
BLG |
WPI |
H-WPI |
Контроль | |
|
2,84 |
3,14 |
2,98 |
0,05 | |
|
1,28 |
1,29 |
1,37 |
0,00 | |
|
0,96 |
1,07 |
1,15 |
0,00 | |
|
4,84 |
4,50 |
4,47 |
0,00 | |
|
Прелин |
1,62 |
1,48 |
1,65 |
0,00 |
|
0,40 |
0,47 |
0,56 |
0,00 | |
|
1,69 |
1,33 |
1,49 |
0,00 | |
|
1,48 |
1,42 |
1,55 |
0,00 | |
|
0,74 |
0,61 |
0,65 |
0,00 | |
|
1,52 |
1,53 |
1,46 |
0,00 | |
|
3,84 |
3,39 |
3,46 |
0,03 | |
|
1,00 |
0,96 |
1,07 |
0,00 | |
|
1,00 |
1,03 |
1,09 |
0,05 | |
|
2,96 |
2,74 |
2,77 |
0,00 | |
|
0,51 |
0,60 |
0,59 |
0,00 | |
|
0,80 |
0,69 |
0,85 |
0,00 | |
|
Всего АК |
27,45 |
26,23 |
27,14 |
0,13 |
|
Всего BСАА |
6,84 |
6,34 |
6,47 |
0,03 |
Все три протеиновых напитка вызывали значительное повышение концентрации аминокислот в плазме крови по сравнению с контролем. Динамика изменений концентрации АК была одинаковой во все временные отрезки после приема WPI и BLG. Однако уровень лейцина и ВСАА в целом в плазме при приеме BLG в период между 45 и 120 минутами был достоверно выше по сравнению с приемом H-WPI (рис.1 и 2). Величина изменений концентраций лейцина и ВСАА в целом при приеме WPI, несмотря на общность изменений во времени, была средней между BLG (относительно максимальные сдвиги концентраций) и H-WPI (относительно минимальные сдвиги концентраций) (рис.1 и 2).
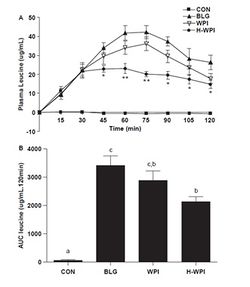
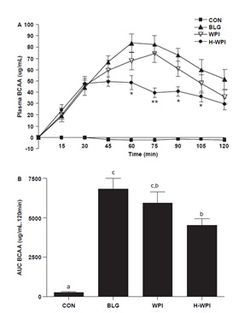
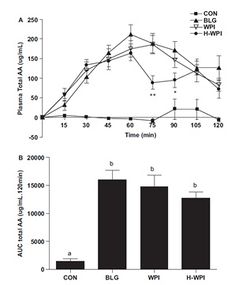
Начиная со 105 минуты исследования происходило постепенное возвращение концентраций всех без исключения аминокислот к исходным уровням (рис.3). Эти данные показывают, что WPI и, особенно BLG, обеспечивают в 1,5-2 раза более мощный подъем концентраций ВСАА (и лейцина, в частности) в плазме крови с 30 по 90 минуты после перорального приема, по сравнению с H-WPI. В то же время, до 30-ой минуты включительно, различий между тремя смесями (напитками) не отмечалось. В контрольной группе существенных изменений концентрации АК в плазме крови не выявлено. Таким образом, несмотря на практически полную идентичность количественного содержания ВСАА (в том числе лейцина) в разных формах WP, обеспечение поступления ВСАА в организм может различаться в 2 раза.
Проведенные исследования позволили сделать очень важный в практическом плане вывод: прогностическая оценка пищевой ценности и эффективности протеинового источника ВСАА (и лейцина, в частности) должна строиться не только на основе количественного содержания ВСАА в протеине, но и на основе фармакокинетики ВСАА после приема данного протеина.
Однако проблемы с выбором WP для адекватного обеспечения ВСАА на этом не заканчиваются. Исходный WP различных производителей существенно отличается по количественным показателям состава, что связано как с характеристиками молочного сырья (сыворотки), так и с добавлением в конечный продукт дополнительного количества ВСАА (характерно для ряда американских WP-комплексов). В работе C.C.Almeida и соавторов (2015) очень наглядно показаны различия в аминокислотном составе WP, произведенных в США и Бразилии (табл.2).
Таблица 2. Концентрации (мг/100 г) свободных незаменимых АК (EAA) и свободных ВСАА в различных формах WP из США и Бразилии (C.C.Almeida и соавт., 2015)
| Аминокислоты | Whey-протеин США | Whey-протеин Бразилия |
|---|---|---|
| Гистидин | 2,7 ± 1,9 | 11,6 ± 21,8* |
| Изолейцин | 95,5 ± 232,3 | 7,8 ± 13,9* |
| Лейцин | 125,6 ± 305,9 | 11,3 ± 19,0* |
| Лизин | 21,1 ± 18,5 | 47,2 ± 61,1* |
| Метионин | 5,2 ± 8,1 | 5,1 ± 7,6 |
| Фенилаланин | 13,8 ± 17,5 | 16,5 ± 28,0 |
| Треонин | 3,1 ± 4,3 | 9,2 ± 16,7* |
| Валин | 110,9 ± 278,8 | 9,7 ± 17,0* |
| ΣEAA | 378,1 ± 854,9 | 118,7 ± 183,0 |
| ΣВСAA | 332,0 ± 816,7 | 28,9 ± 49,9* |
Примечания: ΣEAA – сумма незаменимых АК; ΣВСAA – сумма лейцина, изолейцина и валина; * - достоверные отличия (Р<0,01); В таблице приведены усредненные данные по 10 WP для каждой страны: в Бразилии - 5 образцов WPI и 5 образцов WPC; в США – 5 образцов WPI и 5 образцов смеси WPI+WPC (WPCI). Остальные объяснения в тексте.
Как видно из таблицы, различия по основным АК из группы ВСАА достигают целого порядка, что обусловлено не только качеством молочного сырья, но и направленным добавлением ВСАА в некоторые конечные продукты, произведенные в США для усиления анаболического действия ВСАА на синтез мышечных белков.
Еще один момент, затрудняющий прогностическую оценку: примерно в 40% продукции из США содержание белка было ниже заявленного на этикетке, в то время как в продуктах из Бразилии в 70% случаев отмечено совпадение декларируемого и реального содержания белка. Сходные результаты получены в независимой частной лаборатории Consumer Lab (2014), специализирующейся на оценке качества пищевой продукции: из 24 коммерческих форм WP, произведенных в США, 31% не соответствовал заявленному количеству белка, а, следовательно, и аминокислот.
ВСАА из других протеиновых источников
Природные растительные белки по своему аминокислотному составу проигрывают WP. Однако, в процессе производства они могут дополнительно обогащаться незаменимыми (особенно, ВСАА) АК таким образом, что их состав в значительной мере приближается к составу WP (пример – табл. 3).
Таблица 3. Сравнительный состав по незаменимым АК, ВСАА и лейцину двух вариантов добавок протеинов (на 25 г белка)
| Аминокислоты | Сложный растительный протеин в г. | Whey-протеин в г. |
|---|---|---|
| Незаменимые АК | 11 | 12,4 |
| ВСАА | 7,5 | |
| Лейцин | 2,5 | 3,0 |
Примечания: сложный растительный протеин – комбинированная смесь протеинов на основе белка гороха. Остальные объяснения в тексте.
Сходным образом, при изготовлении конечной формы современных животных протеинов осуществляется их обогащение ВСАА. Примером может служить одна из последних разработок компании «Dimatize» - «Dymatize Nutrition Elite Primal». В дополнение к аминокислотам, полученным из говяжьего белка, специалисты компании добавили в препарат Elite Primal (гидролизованные пептиды ВР; гидролизат изолята говяжьего белка – H-BIP; говяжий альбумин) дополнительные свободные аминокислоты с разветвленной цепью (ВСАА) и креатин. Это приводит к выравниванию физиологической ценности говяжьих протеиновых смесей и смесей на основе сывороточного протеина.
Таким образом, нельзя однозначно говорить о преимуществах и недостатках тех или иных форм протеиновых смесей в плане количества ВСАА и лейцина только на основании источника получения (молочный, мясной, рыбный, гороховый, пшеничный и т.д. протеин). В современной спортивной нутрициологии важен качественный и количественный состав конкретного протеинового продукта, в первую очередь, данные о ВСАА, а также фармакокинетика аминокислот смеси. Количественные параметры содержания ВСАА в продукте хорошего качества обязательно указываются на этикетке и во вложенной Инструкции.
Метаболизм ВСАА в клетках скелетной мускулатуры
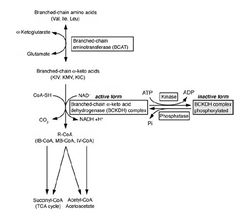
Биохимические процессы в клетках скелетных мышц с участием ВСАА показаны на рис.4.
Существуют два фермента, необходимых для метаболических изменений ВСАА: митохондриальная дегидрогеназа и дегидрогеназа кето-кислот с разветвленной цепью (комплекс BCKADH). После превращения ВСАА в их кето-форму (под влиянием аминотрансферазы ВСАТ), получившиеся кето-кислоты могут использоваться мышцами в цикле Кребса для продукции АТФ (топливо для мышц), или транспортироваться в печень для окисления. После окисления кето-кислот образовавшиеся оксо-кислоты могут использоваться в печени как источник энергии. В конечном счете, ВСАА составляют около 35% всей мышечной ткани, а продукты их метаболизма как в мышцах, так и в печени способствуют энергообеспечению.
Общие принципы участия ВСАА в мышечном метаболизме при физических нагрузках
Суммарно, 6 аминокислот принимает участие в образовании энергии в мышечной ткани: аланин, аспартат, глутамат и три ВСАА (S.Sowers, 2009), но роль ВСАА наиболее велика. Мышечная ткань содержит 60% специфических ферментов, необходимых для окисления аминокислот с целью получения энергии, особенно ВСАА. В процессе тренировок организм использует ВСАА как источник энергии. Чем интенсивнее и продолжительнее нагрузки, тем в большей мерее используются ВСАА. Установлено, что от 3% до 18% всей рабочей энергии обеспечивают ВСАА, но эта доля может значительно меняться в зависимости от характера тренировочной нагрузки. Особенно высока потребность в лейцине. Доля свободного (легко доступного для получения энергии) лейцина в общем пуле свободных аминокислот в 25 раз выше других. Мышц это касается особенно, поскольку пул свободных аминокислот в скелетных мышцах – 75%. ВСАА также могут конвертироваться в мышцах в L-аланин или L-глутамин. Две последних аминокислоты в процессе гликонеогенеза в печени могут превращаться в глюкозу. Лейцин также непосредственно стимулирует синтез протеинов за счет своей сигнальной роли (увеличивает поступление аминокислот внутрь клеток). BCAA при приеме в виде свободных аминокислот разделяется на фракцию, идущую в печень и кишечник, а также фракцию, поступающую прямо в кровоток. Пищевые добавки ВСАА в свободной форме быстро повышают концентрацию этих незаменимых аминокислот в плазме крови. Этот факт надо помнить, когда спортивный врач рассчитывает время, дозу и форму подачи ВСАА в организм с определенной тренировочной задачей: ВСАА в связанной форме (в составе диеты или в составе WP) обеспечит относительно медленное, но длительное поступление ВСАА в мышцы; ВСАА в чистом виде – быстрое, но кратковременное анаболическое действие. Роль этого фактора становится особенно важной при снижении запасов гликогена в мышцах и/или при ограничении поступления углеводов в организм в целом (например, низкоуглеводная диета). Пищевые добавки BCAA эффективны как при приеме до, так и после тренировок. Хотя роли лейцина отводится ведущее место в этих процессах, большинство экспертов считает прием данной аминокислоты в составе комплекса ВСАА более эффективным.
Читайте также
- Исследования эффектов BCAA
- Прием BCAA
- BCAA и тренировки
- L-карнитин: вред и побочные эффекты
- Карнитин (медицинское применение)
- АТФ: научный обзор
- Бета-аланин: научный обзор
- Глутамин: научный обзор
- HMB: научный обзор
- Донаторы оксида азота: научный подход
- Креатин: научный обзор
- Нейростимуляторы и нейропротекторы в спортивном питании: научный обзор
- Омега-3 жирные кислоты: научный обзор
- Омега-5 жирные кислоты: научный обзор
- Омега-7 жирные кислоты: научный обзор
- Спортивные напитки: научный обзор
- Препараты витамина D в спортивной медицине: научный обзор
Ссылки
- Almeida C.C., Alvares T.S., Costa M.P., C.A.Conte-Junior. Protein and Amino Acid Profiles of Different Whey Protein Supplements. J.Dietary Suppl., 2015, 3:1-11.
- Bassit R.A., Sawada L.A., Bacurau R.F. et al. Branched-chain amino acid supplementation and the immune response of long-distance athletes. Nutrition, 2002,18(5):376-379.
- Blomstrand E., Andersson S., Hassmen P. et al. Effect of branched-chain amino acid and carbohydrate supplementation on the exercise-induced change in plasma and muscle concentration of amino acids in human subjects. Acta Physiol.Scand., 1995, 153:87–96.
- Blomstrand E., Essen-Gustavsson B. Changes in amino acid concentration in plasma and type I and type II fibers during resistance exercise and recovery in human subjects. Amino Acids, 2009, 37: 629-636.
- Brosnan J.T., Brosnan M.E. Branched-Chain Amino Acids: Enzyme and Substrate Regulation. J.Nutr., 2006, 136: 207S–211S.
- Burke L. M. branched-Chain Amino Acids (BCAAs) and Athletic Performance. International Sports Medicine Journal, 2001, 2 (3).
- Campbell B., Kreider R.B., Ziegenfuss T. et al. International Society of Sports Nutrition position stand: protein and exercise. J.Int.Soc.Sports Nutr., 2007, 4:8.
- Consumer Lab. Protein powders and drinks review—for body building, sports & dieting. 2014. Accessed Jun. 21, 2014.
- ConsumerReport.org. Consumer Reports Magazine. How much protein? 2010. Accessed Jun. 23, 2014.
- Contro V., Mancuso E.P., Proia P. Delayed onset muscle soreness (DOMS) management: present state of the art. TRENDS in Sport Sciences, 2016, 3(23): 121-127.
- Coombes J.S., McNaughton L.R. Effects of branched-chain amino acid supplementation on serum creatine kinase and lactate dehydrogenase after prolonged exercise. J.Sports Med.Phys.Fitness, 2000, 40:240–246.
- Cynober L.C., Harris R. A. Symposium on Branched-Chain amino acids: Conference summery. J.Nutrition, 2006, 136: 333-336.
- da Luz C.R., Nicastro H., Zanchi N.E. Potential therapeutic effects of branched-chain amino acids supplementation on resistance exercise-based muscle damage in humans. J.Intern.Soc. Sports Nutr., 2011, 8:23.
- Dietary Reference Intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids (Macronutrients) (2005) National Academy of Sciences. Institute of Medicine. Food and Nutrition Board.
- Farnfield M.M., Trenerry C., Carey K.A., Cameron-Smith D. Plasma amino acid response after ingestion of different whey protein fractions. Intern.J.Food Sci.Nutr., 2009, 60(6):476-486.
- Garlick P.J., Grant I. Amino acid infusion increases the sensitivity of muscle protein synthesis in vivo to insulin. Effect of branched-chain amino acids. Biochem J., 1988, 254(2):579-584.
- Gastmann U.A., Lehmann M.J. Overtraining and the BCAA hypothesis. Medicine and Science in Sports and Exercise, 1998, 30, 1173-1178.
- Gatorade Sports Science Institute, FC Barcelona Medical Services. Sports Nutrition Recommendations 2014-2016.
- Greer B.K., Woodard J.L., White J.P. et al. Branched-chain amino acid supplementation and indicators of muscle damage after endurance exercise. Int.J.Sport Nutr.Exerc.Metab., 2007, 17:595–607.
- Harris R.A., Joshi M., Jeoung N.H., Obayashi M. Overview of the molecular and biochemical basis of branched-chain amino acid catabolism. J.Nutr., 2005, 135(6 Suppl):1527S-1530S.
- Hefler S.K.,Wildman L., Gaesser G.A. et al. Branched-chain amino acid (BCAA) supplementation improves endurance performance in competitive cyclists. Medicine and Science in Sports and Exercise, 1993, 25, S24 (abstract).
- Howatson G., van Someren K.A. The prevention and treatment of exerciseinduced muscle damage. Sports Med., 2008, 38(6):483-503.
- Hutson S.M., Sweatt A.J., Lanoue K.F. Branched-chain [corrected] amino acid metabolism: implications for establishing safe intakes. J.Nutr., 2005, 135(6 Suppl):1557S-1564S.
- Jackman S.R., Witard O.C., Jeukendrup A.E., Tipton K.D. Branched-chain amino acid ingestion can ameliorate soreness from eccentric exercise. Med.Sci.Sports Exerc., 2010, 42(5):962-970.
- Jitomir J., Willoughby D. S. Leucine for Retention of Lean Mass on a Hypocaloric Diet. Journal of Medicinal Food, 2008, 11 (4): 606-609.
- Karlsson H.K., Nilsson P.-A., Nilsson J. et al. Branched-Chain amino acids increase p70s6k phophoralation in human skeletal muscle after resistance exercise. American Journal of Physiology Endocrinolgy and Metabolism, 2004, 287: 1-7.
- Koba T., Hamada K., Sakurai M. et al. Branched-chain amino acids supplementation attenuates the accumulation of blood lactate dehydrogenase during distance running. J.Sports Med.Phys.Fitness, 2007, 47:316–322.
- Kreider R.B., Wilborn C.D., Taylor L. et al. ISSN exercise & sport nutrition review: research and recommendations. J.Intern.Soc.Sports Nutr., 2010, 7:7-50.
- Mayers J.R., Torrence M.E., Fiske B.P. Analysis of Whole-Body Branched-Chain Amino Acid Metabolism in Mice Utilizing 20% Leucine 13C6 and 20% Valine 13C5 Mouse Feed. Cambridge Isotope Laboratories, Inc. isotope.com, 2014.
- Mikulski T., Ziemba A.W., Chmura J. et al. The effect of supplementation with branched chain amino acids (BCAA) on psychomotor performance during graded exercise in human subjects. Biol Sport, 2002, 19: 295-301.
- Newsholme E.A.,Parry-Billings M., McAndrew M. et al Biochemical mechanism toexplain some characteristics of overtraining. In Brouns F (editor):Medical Sports Science, 1991, 32, Advances in Nutrition and Top Sport(pages 79-93). Basel, Germany: Karger.
- Nosaka K., Sacco P., Mawatari K. Effects of amino acid supplementation on muscle soreness and damage. Int.J.Sport Nutr.Exerc.Metab., 2006, 16(6):620-635.
- Sharp C.P., Pearson D.R. Amino acid supplements and recovery from highintensity resistance training. J Strength Cond Res 2010, 24(4):1125-1130.
- Shimomura Y., Obayashi M., Murakami T., Harris R.A. Regulation of branched-chain amino acid catabolism: nutritional and hormonal regulation of the expression of the branched-chain a keto acid dehydrogenase kinase. Curr.Opin.Clin.Nutr.Metab.Care, 2001, 4:419–423.
- Shimomura Y., Yamamoto Y., Bajotto, G. et al. Exercise promots BCAA catabolism: Effects of BCAA supplementation on skeletal muscle druing exercise. J.Nutrition, 2006, 136: 529-532.
- Shimomura Y., Kobayashi H., Mawatari K. et al. Effects of squat exercise and branched-chain amino acid supplementation on plasma free amino acid concentrations in young women. J.Nutr. Sci.Vitaminol. (Tokyo) 2009, 55(3):288-291.
- Sowers S. A Primer On Branched Chain Amino Acids. Huntington College of Health Sciences, 2009, 1-6.
- Spillane M., Schwarz N., Willoughby D.S. Heavy resistance training and peri-exercise ingestion of a multi-ingredient ergogenic nutritional supplement in males; effects on body composition, muscle performance and markers of muscle protein synthesis. J.Sport Sci.Med., 2012, 13:894–903.
- Wu G. Intestinal Mucosal Amino Acid Catabolism. . J. Nutr., 1998, 128: 1249–1252.
- Zanchi N.E., Nicastro H., Lancha A.H.Jr. Potential antiproteolytic effects of L-leucine: observations of in vitro and in vivo studies. Nutr.Metab. (Lond), 2008, 5:20.
