Протеолитические ферменты
Содержание
- 1 Протеолитические ферменты в спортивной медицине (обзор литературы)
- 2 Протеолитические ферменты на медицинском и фармацевтическом рынке
- 3 Происхождение, химическая структура, классификация и свойства протеолитических ферментов
- 4 Фармакокинетика протеолитических ферментов
- 5 Протеолитические ферменты – катализаторы высвобождения аминокислот (АК) из протеинов
- 6 Протеолитические ферменты как фармаконутриенты для предупреждения и лечения EIMD и DOMS
- 7 Грибковые протеазы – новое направление в создании ферментных фармаконутриентов для спортивной медицины
- 8 Заключение
- 9 Читайте также
- 10 Ссылки
Протеолитические ферменты в спортивной медицине (обзор литературы)[править | править код]
Авторы: д.м.н. Александр Владимирович Дмитриев, врач-эндокринолог Алексей Александрович Калинчев
Интерес к протеолитическим ферментам (ПФ) в спортивной нутрициологии и в спортивной медицине в целом связан с двумя неоспоримыми свойствами этих биологически активных добавок (БАДов). Во-первых, они являются частью естественной системы переваривания протеинов и пептидов в желудочно-кишечном тракте (ЖКТ), что обеспечивает более высокий уровень расщепления молекул белка с образованием низкомолекулярных пептидов и аминокислот (особенно ВСАА и глутамина) с их собственным эргогенным действием. Во вторых, исследования последних лет показали способность протеолитических ферментов при однократном и курсовом назначении уменьшать микроповреждения скелетной мускулатуры (Exercise-Induced Muscle Damage - EIMD) и отсроченную болезненность мышц после физических нагрузок (Delayed Onset of Muscle Soreness - DOMS). Оба этих фактора в совокупности с природным происхождением ПФ и высоким уровнем безопасности (широкий терапевтический диапазон), делает данную группу БАДов перспективными средствами нутритивно-метаболической поддержки (НМП) как начинающих, так и профессиональных спортсменов. Ряд других параметров фармакологического действия протеолитических ферментов (дозо-зависимость эффекта, определенная специфичность по отношению к субстратам, наличие схем дозирования и пр.) позволяет отнести этот класс веществ к фармаконутриентам.
Протеолитические ферменты на медицинском и фармацевтическом рынке[править | править код]
Протеолитические ферменты растительного и животного происхождения очень давно и широко используются в медицинской практике для лечения нарушений переваривания и всасывания пищи в ЖКТ и функции поджелудочной железы. Исторически первыми были пищевые добавки и препараты, содержащие ферменты поджелудочной железы свиней и коров для заместительной терапии недостаточности этого органа. Растительные энзимы, например бромелаин из ананаса, также оказались эффективны для обеспечения переваривания протеинов[1]. Такой эффект протеолитических ферментов обеспечил первое, с исторической точки зрения, направление применения этой группы веществ – усиление переваривания протеинов, ускоренное высвобождение аминокислот (АК), включая ВСАА, и абсорбцию легких пептидов и АК в кишечнике при абсолютной или относительной недостаточности эндогенного образования протеаз. По мере развития научной медицинской мысли и накопления опыта использования протеолитических ферментов, формировалось еще одно, не менее важное направление – адъювантная терапия (сопровождение) таких состояний и заболеваний как острая и постхирургическая травма, флебиты, ревматоидный артрит и остеоартриты, злокачественные опухоли и т.д.[2][3][4]. Пероральное применение протеолитических ферментов (иначе называемых протеазами или протеиназами) по тем или иным показаниям называют Системной Энзимной Терапией (Systemic Enzyme Therapy - SET), поскольку рассчитано на всасывание и распределение в организме ферментов с последующим действием во внутренних средах органов и тканей. Регуляторный статус ферментов этого класса различен и варьирует от рецепторных лекарственных препаратов до ОТС-формул и даже пищевых добавок, с определенной спецификой для отдельных стран. В состав комбинированных препаратов также включают витамины, минералы и другие пищевые добавки, в частности, олигомерные проантоцианидины, кверцетин и т.д.
Наиболее часто встречаемые на рынке варианты комбинированных составов с протеазами приведены в таблице 1.
Таблица 1. Основные активные ингредиенты некоторых типовых комбинированных препаратов протеолитических ферментов на фармацевтическом рынке США и Европы[5]
|
Вещество |
Вариант состава 1 |
Вариант состава 2 |
Вариант состава 3 |
|
90 мг = 900 F.I.P.-ед. |
45 мг = 450 F.I.P.-ед. |
133-178 мг = 800 ед. | |
|
- |
60 мг = 328 F.I.P.-ед. |
- | |
|
- |
100 мг = 300 Ph. Eur. - ед. протеиназы |
- | |
|
- |
1 mg = 596 F.I.P.-ед |
- | |
|
48 мг = 24 μkat |
24 мг = 12 μkat |
- | |
|
Рутозид |
100 мг |
50 мг |
- |
Примечания: *1 μkat – количество фермента, которое превращает более 1 μM субстрата в секунду при стандартных условиях. Это соответствует 60 F.I.P – единиц. Ph. Eur.-ед протеиназы – протеиназные единицы действия по Европейской Фармакопее. Рутозид (рутин, кверцетин-3-О-рутинозид, софорин) — гликозид флавоноида кверцетина.
Как видно из таблицы 1, в большинстве случаев при формировании состава комбинированных протеолитических препаратов используются растительные протеазы цистеина – бромелайн (обязательный компонент) и папаин, а также протеазы серина животного происхождения – трипсин и химотрипсин. Некоторые составы включают панкреатин, амилазу, липазу и/или рутозид. Популярной формой выпуска являются кишечнорастворимые таблетки, покрытые оболочкой, для обеспечения наибольшей концентрации активных веществ в кишечнике (предотвращение распада таблетки в кислой среде желудка). Дозировки ферментов варьируют в диапазоне от 1 до 200 мг/таблетку. Количество протеаз в дозе на прием соответствует ферментной активности, описанной в F.I.P. (F.I.P.-units of the Federation Internationale Pharmaceutique). Одна F.I.P.-единица – количество фермента, которое способно конвертировать более 1 мкмол субстрата за 1 минуту при стандартных условиях.
Происхождение, химическая структура, классификация и свойства протеолитических ферментов[править | править код]
Растительные протеазы.[править | править код]
Протеазы дынного дерева[править | править код]
В соответствии с данными А.М.Пенджиева и А.Абдуллаева[2] «высушенный млечный сок (латекс) дынного дерева содержит ряд протеаз: Папаин – монотиоловая цистеиновая эндопротеаза. По характеру ферментативного действия ее называют «растительным пепсином». Но, в отличие от пепсина, папаин активен не только в кислых, но и в нейтральных и щелочных средах (диапазон рН 3–12, оптимум рН=5), что важно при часто встречающихся у спортсменов нарушениях кислотного состава желудка. Химопапаин – монотиоловая цистеиновая протеиназа. Благодаря субстратной специфичности похожа на папаин, но отличается от него электрофоретической подвижностью, стойкостью и растворимостью. Протеиназа IV – цистеиновая протеиназа, основная протеиназа латекса, составляет около 30 % присутствующего в нем белка. Проявляет высокую степень гомологии с протеиназой III папайи (81 %), химопапаином (70 %) и папаином (67 %). Очень близка к химопапаину по молекулярной массе и заряду молекулы. Карикаин – наиболее щелочная среди цистеиновых протеиназ латекса папайи. Подобно папаину, карикаин сначала продуцируется в форме неактивного зимогена прокарикаина, содержащего ингибиторный прорегион из 106 N-терминальных аминокислот. Активация фермента заключается в отщеплении прорегиона молекулы без ее последующих конформационных изменений. Протеиназа w (эндопептидаза А, пептидаза А) – монотиоловая цистеиновая протеиназа. Это полипептид, содержащий 216 аминокислотных остатков и 3 дисульфидные связи. Для проявления его ферментативной активности важно наличие свободного остатка цистеина в активном центре. Проявляет высокую степень гомологии с папаином (68,5 %). По специфичности ферментативного действия напоминает папаин, поскольку связывается с субстратом в участках локализации дисульфидных связей. Для стабилизации комплекса протеиназ папайи с практическими целями используются специальные полимеры, разработанные еще во времена существования СССР.
Протеазы ананаса[править | править код]
Физико-химические свойства основной комплексной смеси протеолитических ферментов ананаса – бромелаина, - и применение его в клинических условиях, подробно описаны в нескольких обзорах[6][7][8][9], выполненных в научных лабораториях стран - мест произрастания и высокотехнологичной переработки ананаса (в основном, Индии). Бромелаин представляет собой водный экстракт из плодов необработанного ананаса. Это смесь различных тиоловых эндопептидаз и ряда других активных веществ, например фосфатаз, глюкозидаз, пероксидаз, целлюлаз, гликопротеинов, углеводов и некоторых ингибиторов протеаз[7]. При этом бромелаин, получаемый из стеблей ананаса отличается по составу от такового из плодов ананаса. Как и в случае папаина, ферментативная активность бромелаина сохраняется в широком диапазоне изменений рН – от кислой до щелочной – 5,5 – 8,0[10]. В настоящее время бромелаин производят из охлажденного ананасового сока путем центрифугирования, ультрафильтрации и лиофилизации. Ферментативная активность получаемого порошка определяется эмпирически на таких белковых субстратах как казеин (FIP-единицы), желатин (единицы переваривания желатина) или хромогенные трипептиды[6].
Протеазы животного происхождения[править | править код]
Трипсин и химотрипсин – самые известные и клинически изученные сериновые протеазы (эндопептидазы) животного происхождения. В отличие от растительных протеаз, оптимум каталитической активности сериновых протеаз находится в щелочном диапазоне. Трипсин синтезируется в поджелудочной железе в виде неактивного предшественника (профермента) трипсиногена. Трипсин содержит в активном центре остатки серина и гистидина. Молекула бычьего трипсина (молекулярная масса около 24 кДа) состоит из 223 аминокислотных остатков, образующих одну полипептидную цепь, и содержит 6 дисульфидных связей. Изоэлектрическая точка трипсина лежит при pH 10,8, а оптимум каталитической активности — при pH 7,8—8,0. Химотрипсин – протеаза, катализирующая гидролиз пептидной связи, рядом с которой находится ароматическая аминокислота (триптофан, фенилаланин, тирозин). Механизмы действия трипсина и химотрипсина, а также области их применения в клинической медицине хорошо изучены и отражены в целом ряде руководств, систематических обзоров и мета-анализов[11][12][13][14].
Фармакокинетика протеолитических ферментов[править | править код]
Абсорбция ПФ в желудочно-кишечном тракте и их биологическая активность[править | править код]
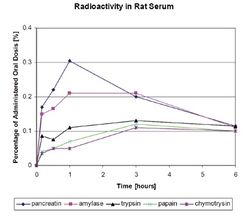
В обзорной работе G.Lorkowski[5] суммированы имеющиеся данные по абсорбции протеолитических ферментов в ЖКТ после их перорального приема, фармакокинетике ПФ и даны возможные объяснения механизмам этих процессов. Ранние исследования абсорбции протеаз у животных были выполнены путем перорального приема ферментных субстратов, меченых радиоактивными изотопами. Другим методом было количественное определение в плазме крови собственной эстеразной активности протеаз в отношении специфических субстратов, например, этилового эфира N-бензолил-L-аргинина (BAEE) как субстрата для трипсина, а этилового эфира N-ацетил-L-тирозина (ATEE) как субстрата для химотрипсина, а уровня гемоглобина – для оценки общей протеолитической активности. Экспериментальные исследования показали, что абсорбция протеолитических ферментов зависит от множества факторов, среди которых наиболее важным является размер молекулы. В серии экспериментальных работ J.Seifert и соавторов[15][16] было показано, что после перорального приема (рис.1) меченых йодом-123 таких протеолитических ферментов как трипсин, химотрипсин, панкреатин и папаин, наблюдается постепенное нарастание концентрации протеолитических ферментов в крови, дифференцированное по времени и количественным параметрам в зависимости от конкретного протеолитического фермента. Прием панкреатина вызывал наибольший прирост концентрации фермента в сыворотке крови с максимумом в течение часа. В течение последующих 6-и часов происходило плавное снижение его концентрации. Для других протеолитических ферментов (трипсин, химотрипсин и папаин) максимальная концентрация в сыворотке крови достигалась только к 3-ему часу после перорального применения и была существенно ниже (в 3 и более раз) по сравнению с панкреатином. Характерно, что через 6 часов для всех ферментов уровень их концентрации в крови (в процентном соотношении с их введенной дозой на 1 г крови) был примерно одинаковым.
Детальные количественные характеристики изменений показателей ПФ в крови даны в таблице 2.
Таблица 2. Количественный анализ абсорбции ферментов в кишечнике крыс в сыворотку крови и лимфу (из J.Seifert и соавт., 1990).
|
Фермент |
Доза на прием, мг |
Общий уровень абсорбции, (%)* |
Общий уровень абсорбции (мг) |
Высокомолекулярная часть, (%) |
Низкомолекулярная часть (мг) |
Низкомолекулярная часть (%) | |
|
Сыворотка |
Лимфа | ||||||
|
Амилаза |
10 |
59 |
5,9 |
77,1 |
73,7 |
4,35-4,55 |
43,5-45,5 |
|
Химотрипсин |
5 |
38,1 |
1,91 |
37,3 |
57,3** |
0,71-1,09 |
14,2-21,9 |
|
Панкреатин |
2,25 |
36,6 |
0,82 |
50,3 |
55,7 |
0,41-0,46 |
18,4-20,3 |
|
Папаин |
5 |
26 |
1,3 |
24,1 |
60,6** |
0,31-0,79 |
6,27-15,8 |
|
Трипсин |
5 |
49,6 |
2,48 |
54.2 |
68.7** |
1,34-1.7 |
26,9-34,1 |
Примечания: * - общий уровень абсорбции рассчитывался как показатель радиоактивности субстрата при приеме внутрь, пониженный за счет остаточной радиоактивности в кишечнике без дифференциации на высокий или низкий молекулярный вес материала. ** - Из-за различий между концентрацией протеаз высокого молекулярного веса в сыворотке и лимфе, расчетное общее количество абсорбированного высокомолекулярного материала ниже.
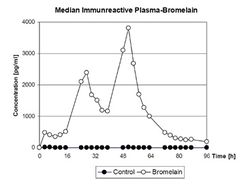
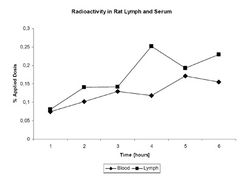
Абсорбция бромелаина при интрадуоденальном введении в экспериментах на крысах существенно отличалась от таковой других протеолитических ферментов. Как видно из рис.2, происходит медленное (по сравнению с другими ПФ) нарастание концентрации бромелаина в сыворотке крови и лимфе в течение 4 часов (максимум) и поддержание этих величин до 6-и часов наблюдения. В данной работе уровень абсорбции бромелаина определен в 50% от введенной дозы за 6 часов, при этом 80% составила высокомолекулярная фракция.
Фармакокинетика ПФ у человека[править | править код]
Наиболее подробные фармакокинетические исследования у человека были выполнены с использованием бромелаина, трипсина и папаина[18][19]. В рандомизированном контролируемом двойном-слепом фармакокинетическом исследовании приняло участие 19 здоровых мужчин в возрасте 18-45 лет (рис.3, табл.3).
Таблица 3. Фармакокинетические показатели бромелаина в плазме крови здоровых мужчин-добровольцев после перорального приема кишечнорастворимых таблеток бромелаина[18][19].
|
Cмакс (нг/мл) |
Тмакс (час) |
Т1/2 (час) |
AUC (нг/час х мл) | |
|
Мин значение |
1,83 |
51 |
6,2 |
31,2 |
|
Макс значение |
9,47 |
24 |
7,1 |
215,1 |
|
Среднее |
4,93 |
44 |
6,1 |
82,2 |
|
Стандартное отклонение |
2,40 |
11 |
1,2 |
42,0 |
Таблица 4. Линейная зависимость максимальных уровней ПФ в плазме крови испытуемых в соответствии с перорально принимаемой суточной дозой ферментных препаратов[20][21][22]
|
Бромелаин |
Трипсин |
Папаин | |||
|
ДД |
МКП |
ДД |
МКП |
ДД |
МКП |
|
1,08 |
2,5 |
0,38 |
1,2 |
1,44 |
2,5 |
|
1,44 |
3,8 |
0,72 |
2,0 |
1,80 |
2,7 |
|
2,16 |
4,8 |
0,77 |
2,2 |
2,88 |
6,0 |
|
2.88 |
5.6 |
1,44 |
3,7 |
3.60 |
5,2 |
Примечания: ДД – дневная доза (г); МКП – максимальная концентрация в плазме (нг/мл).
15 добровольцев получали кишечно-растворимые таблетки, каждая из которых содержала 200 мг бромелайна. Четверо испытуемых служили контролем (плацебо). В течение 1-го дня осуществлялось шесть приемов бромелаина: 3 таблетки в 8.00 утра (время «ноль» для исследования); в 11.00; 14.00; 17.00 и 20.00, а затем 5 таблеток в 23.00. Такой же режим соблюдался на 2-ой день. На 3-ий день осуществлялся только дин прием 3-х таблеток в 8.00. Стандартные приемы пищи производились в: 9.00; 12.00; 15.30 и 18.30. Образцы крови (12 мл) брались каждый раз перед приемом бромелаина. У большинства участников Смакс отмечалась через 48 часов и составляла в среднем 5 нг/мл, Т1/2 в плазме около 6 часов. AUC за период 3-51 часов составила 82,2 нг/час/мл.
В другой работе коллективом авторов из Института клинической фармакологии в Берлине (Германия)[20][21][22] (табл.4) выявлена четкая дозозависимость концентрации бромелаина, трипсина и папаина в плазме крови от введенной суточной дозы фермента, что еще раз подчеркивает, что протеолитические ферменты являются фармаконутриентами, т.е. сочетают способность влиять на нутритивные процессы подобно фармакологическим агентам.
Подводя итоги выполненным исследованиям фармакокинетики протеолитических ферментов, G.Lorkowski[5] в своем аналитическом обзоре делает следующее заключение: «Прием протеолитических ферментов обеспечивает усвоение организмом физиологически активных протеинов с высоким молекулярным весом. Фармакокинетические исследования показывают дозозависимое линейное нарастание концентрации протеаз в различных средах организма, варьирующее в достаточно широких индивидуальных пределах, медленную динамику абсорбции в кишечнике, быстрое и 100% связывание в организме с антипротеазными комплексами. Пероральный прием протеолитических ферментов увеличивает протеазную активность сыворотки крови с параллельным возрастанием концентрации в плазме крови соответствующих антипротеаз. Биологическая протеолитическая активность пероральных ПФ определяется взаимодействием с соответствующими рецепторами на поверхности клеток (протеаз-активируемые рецепторы) как в виде свободных протеаз, так и в комплексной форме с антипротеазами. Такой комплекс «протеаза-антипротеаза» вызывает возрастание плазменных концентраций антипротеаз и элиминацию самих комплексов и цитокинов. Эти механизмы реализуются при приеме внутрь протеолитических ферментов в виде кишечнорастворимых таблеток с содержанием растительных и животных протеаз, и обеспечивают стабилизацию и, возможно, улучшение физиологических и иммунологических процессов даже у здоровых лиц. Последнее обстоятельство приобретает особый смысл в спортивной медицине.
Протеолитические ферменты – катализаторы высвобождения аминокислот (АК) из протеинов[править | править код]
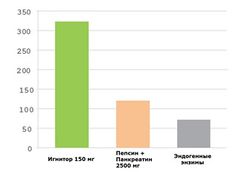
Одним из наиболее популярных БАДов, содержащих протеолитические ферменты, является Игнитор («IGNITORТМ») - матрица с включением двух типов ферментов-аминопептидаз – эндопептидаз и экзопептидаз. Эндопептидазы гидролизуют молекулу белка путем разрыва внутренних пептидных связей, высвобождая пептиды с низким молекулярным весом. Экзопептидазы осуществляют гидролиз белка в концевых участках белковой молекулы, способствуя высвобождению отдельных аминокислот (ВСАА и глутамин). Это позволяет спортсмену или просто тренирующемуся лицу использовать гораздо более приятные в органолептическом плане формы молочного белка по сравнению с гидролизатами белка, а процесс гидролиза осуществляется in vivo. Кроме того, повышение эффективности высвобождения аминокислот из белка под влиянием ПФ позволяет использовать меньшие дозы протеинов и снизить риск возникновения побочных эффектов, связанных с избыточным потреблением молочных протеинов (снижение переваривания, повышенное газообразование, диспептические нарушения и т.п.). В статье J.Bartos[23] приводятся данные сравнительных фармакокинетических исследований ферментного комплекса Игнитор (150 мг) в плане влияния на высвобождение ВСАА и глутамина из WP-концентрата (40 г – стандартизированная доза WPC). В качестве контроля (смесь сравнения) использовалась комбинация пепсина и панкреатина (2500 мг). Как видно из рис.4, Игнитор увеличивает высвобождение L-глутамина из WPC примерно в 3 раза больше, чем смесь пепсина и панкреатина, и в 4,25 раза больше по сравнению с действием только эндогенных (собственных) ПФ.
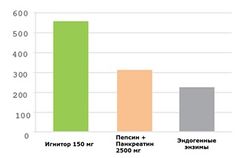
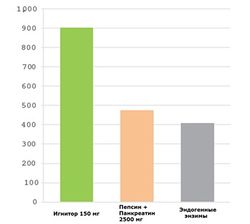
Сходным образом (рис.5), 150 мг Игнитора в 2 раза усиливает высвобождение лейцина из WPC по сравнению со смесью пепсина и панкреатина, и в 2,5 раза – по сравнению только с эндогенными ферментами. Почти такое же преимущество (рис.6) имел Игнитор и в плане высвобождения ВСАА в целом: в 2 раза активнее смеси пепсина и панкреатина, и в 2,25 раза – эндогенных ПФ.
Замена WPC на изолят (WPI) привела примерно к таким же результатам: 100 мг Игнитора высвобождало в 4 раза больше лейцина, в 3,25 раза больше ВСАА и в 2,25 раза больше глутамина по сравнению с эндогенными ПФ.
Таким образом, смесь протеаз различного происхождения при совместном приеме с whey-протеинами (WPC, WPI) увеличивает и оптимизирует во времени высвобождение из белков ВСАА и глутамина с последующей активацией mTOR, что определяет анаболическую эргогенную активность протеолитических ферментов (ПФ). Эргогенное действие ПФ носит опосредованный характер и проявляется при выборе оптимального соотношения общего количества и качества поступающего белка, собственной активности эндогенных ПФ и количества и протеолитических свойств экзогенных ПФ в составе препаратов и БАДов. Конечным эффектом оптимального приема пищевых добавок протеинов и ПФ в сочетании с силовыми тренировками является увеличение синтеза белка в скелетных мышцах, увеличение размеров мышечных волокон, повышение силы и мощности мышц.
Для повышения эффективности высвобождения ВСАА и глутамина из белка делают комбинированные формы WP и ПФ, в котором уже рассчитаны дозы ферментов, необходимые для оптимального расщепления протеинов (например, Isoject – сочетание изолята WP и Игнитора).
Протеолитические ферменты как фармаконутриенты для предупреждения и лечения EIMD и DOMS[править | править код]
Наряду с опосредованным (через усиление высвобождения аминокислот из протеинов) анаболическим действием, о чем было написано выше, протеолитические ферменты уже многие годы используются как средства Системной Энзимной Терапии (СЭТ – SET). СЭТ позволяет естественным путем затормозить воспалительные процессы в организме, а также частично решать проблему предотвращения развития воспаления, препятствующую процессу восстановления. Пероральное введение протеолитических ферментов создает, хотя и невысокую, но эффективную концентрацию свободных и связанных протеиназ в плазме крови[5]. Такие ПФ как трипсин и бромелаин, как и другие эндогенные протеиназы, могут связываться со специфическими (например, альфа-антитрипсин) и неспецифическими (например, альфа-2-макроглобулин) антипротеазами, и предотвращать неконтролируемую деградацию протеинов. Поэтому, способность ПФ контролировать и предотвращать процесс воспаления, легла в основу исследований влияния ПФ на развитие мышечных повреждений в ответ на нагрузки (EIMD) и отсроченную болезненность мышц (DOMS) у лиц, занимающихся спортом. Влияние протеиназ при пероральном приеме на EIMD было изучено в нескольких клинических работах с фокусированием на изменение болей и/или мышечных функций[24][25][26][27][28]. Эти работы показали, что бромелаин и другие протеиназы могут редуцировать мышечное воспаление после получения повреждений в результате нагрузок.
В частности, в рандомизированном двойном-слепом плацебо-контролируемом перекрестном пилотном исследовании J.K.Udani и соавторы[28] оценивали влияние ПФ на DOMS и связанный с этим дискомфорт у обычной популяции нетренированных (мужчин и женщин) лиц в возрасте от 18 до 45 лет. Трудность оценки результатов этой работы определялась сложностью состава пищевой добавки в капсулах, где выделить эффект каждого из компонентов не представлялось возможным: две капсулы в день содержали суммарно 258 мг ПФ (бромелаин, протеазы из Aspergillus melleus и A. Oryzae; 421 мг экстракта куркумы; 90 мг смеси фитостеролов (бета-ситостерол, кампестерол и стигмастерол); 20 мг витамина С и 6 мг экстракта японского горца (содержит 20% ресвератрола). Количественная оценка мышечных болей проводилась по визуальной аналоговой шкале (VAS) c подразделением на четыре подшкалы (от 0 до 10 баллов). Кроме этого, регистрировались: маркеры воспаления в плазме крови - высокочувствительный С-реактивный белок (hs-CRP), TNF-альфа, интерлейкины IL-1, IL-6; маркер повреждения мышц – креатинфосфокиназа – CPK; стандартные показатели сгибания-разгибания нижних конечностей; диапазон подвижности (ROM) нижних конечностей; расход энергии. Для оценки профиля безопасности пищевых добавок по сравнению с плацебо до начала физических упражнений и через 72 часа после них исследовались: состав форменых элементов крови; функция почек и печени; соотношение протромбиновое время/время частичной тромбопластиновой активизации (PT/PTT). Тестирование проводилось на основе протокола эксцентрических упражнений с приседаниями (нагрузка на квадрицепсы). Результаты исследования показали способность изученных сложных по составу пищевых добавок снижать DOMS и ускорять восстановление нетренированных мужчин и женщин после комплекса эксцентрических упражнений. Доказан высокий уровень безопасности перорального применения ПФ.
В более ранней работе P.C.Miller и соавторов[29] изучено влияние добавок ПФ на DOMS и функцию мышц у бегунов-мужчин (возраст 18-29 лет) в параллельных группах сравнения в холмистой местности (бег под уклон). Комбинированный БАД с протеолитическими и другими ферментами применялся в виде капсул. Каждая капсула содержала 325 мг ферментов поджелудочной железы, 75 мг трипсина, 50 мг папаина, 50 мг бромелаина, 10 мг амилазы, 10 мг липазы, 10 мг лизозима и 2 мг химотрипсина и принималась испытуемыми в течение 4-х дней по 2 капсулы 4 раза в день на пустой желудок за 30 минут до приема пищи в 200 мл воды. В контрольной группе участники получали плацебо в капсулах идентичного вида. Весьма важно, что данный вид бега вызывает достаточно ощутимые микроповреждения мышечных волокон и DOMS. Авторы работы показали, что пероральный прием протеаз редуцирует отсроченные мышечные боли, вызванные физическими нагрузками, что сопровождается ускорением восстановления и улучшением общего настроения и самочувствия у физически активных мужчин. При этом выявлена определенная закономерность: восстановление контрактильной способности мышц происходит быстрее при низкой и средней скоростях бега, чем при высокой скорости. Исследования P.C.Miller и соавторов[29] имеют вполне конкретную прикладную направленность. Лица, впервые начинающие тренировочный процесс без опыта физической подготовки, или пациенты, проходящие курс реабилитации после хирургического вмешательства, особенно при отсутствии консультаций специалиста по ОФП, имеют высокую вероятность развития DOMS. Последняя, в свою очередь, прерывает процесс восстановления или существенно его замедляет. Пищевые добавки ПФ – один из оптимальных способов лечения таких состояний, который снижает боли, ускоряет восстановление мышц. В результате возрастает объем и эффективность тренировочной работы, ускоряется восстановление после травм и операций.
В проспективном рандомизированном двойном-слепом плацебо-контролируемом двух-стадийном исследовании T.Marzin и соавторов[30] была поставлена задача оценить влияние системной энзимной терапии (SET) - целого комплекса протеолитических ферментов (Вобензим), - при пероральном введении до и после интенсивных эксцентрических физических упражнений на функциональные и биохимические параметры EIMD и DOMS у мужчин-спортсменов среднего уровня подготовки. Вобензим представлен на фармацевтическом рынке в виде таблеток, покрытых кишечно-растворимой оболочкой, и содержит в одной таблетке: панкреатин 345 ЕД. Ph.Eur.; папаин 90 ЕД. FIP; рутозид 50 мг; бромелаин 225 ЕД. FIP; трипсин 360 ЕД. FIP; липазу 34 ЕД. FIP; амилазу 50 ЕД. FIP; химотрипсин 300 ЕД. FIP. Другой вариант – Вобензим плюс – содержит бромелаин 450 ЕД. FIP, трипсин 1440 FIP, рутозид 100 мг (без липазы и амилазы). В работе T.Marzin и соавторов[30] использовался Вобензим плюс. Первая стадия исследования была перекрестной с «отмывочным» периодом в 21 день (n=2х14), вторая стадия выполнялась в продолжение первой в параллельных группах сравнения (n=2х22). Прием пищевых добавок начинался за 72 часа до тестировочных физических нагрузок. Испытуемые имели следующие характеристики: возраст 20-50 лет, индекс массы тела (ИМТ) – от 20 кг/м2 до 32 кг/м2, средний уровень физической подготовки. Оценивался также нутритивный статус (НС) стандартными клиническими методами, параметры диеты в течение дня. Документировался уровень физической активности. За 2-4 недели до тестирования брались образцы крови для оценки биохимических и клинических показателей. Вобензим плюс (Wobenzym) принимался испытуемыми на пустой желудок по 4 таблетки три раза в день за 30 минут до еды в 250 мл воды в течение 72 часов до и 72 часов после истощающих эксцентрических упражнений (изокинетическая нагрузка на квадрицепсы). Критериями эффективности были выбраны мышечная сила и болезненность мышц как показатели мышечных повреждений, полученных в результате физической нагрузки. Тестирование проводилось следующим образом: после 5-минутного «разогревочного» периода на эргометре, на десмодроме измерялась максимальная концентрическая сила квадрицепсов бедра на сильнейшей ноге; выполнялось три повторных подхода из 20 максимальных концентрических сокращений с одной минутой перерыва для пассивного восстановления между подходами.
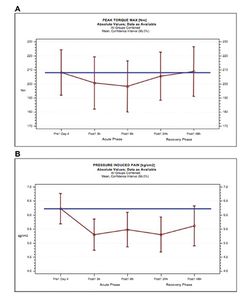
Для анализа бралась максимальная величина показателя. Во время каждого измерения документировались максимальный вращающий момент и угол максимального вращающего момента. Для оценки болезненности мышц использовался такой показатель, как «давление, вызывающее боль» (PIP) - величина постоянно растущего механического давления на мышцу металлического диска площадью 1 см2 , вызывающая начальные ощущения дискомфорта. Суммарные результаты исследования показаны на рисунках 7 и 8.

Как видно из представленных авторами графиков, в острой фазе постнагрузочного периода происходит последовательное снижение PTM: на 3,4% (201 Nm) через 3 часа и на 4,8% (198 Nm) - через 6 часов по отношению к базовым значениям, принятым за 100% (201 Nm) (рис.7А). Однако, в «восстановительной фазе» (24-48 часов) средние значения PTM постепенно возвращаются к исходным величинам (205Nm на 24 часе и 209Nm на 48 часе), зафиксированным до начала выполнения упражнений. Параллельно происходит увеличение болевой чувствительности, проявляющееся снижением порога ощущения боли по тесту альгиметрии (рис.7В) при механическом воздействии на мышцу. Максимальное снижение болевого порога отмечено на 3 часе после нагрузки (с базовых 6,2 кг/см2 до 5,3 кг/см2) с сохранением близких значений вплоть до 24 часа. Через 48 часов отмечена тенденция к восстановлению исходных значений, но далеко не в полном объеме (в среднем 5,6 кг/см2). Системная энзимная терапия препятствовала как снижению РТМ (рис.8), так и развитию гиперальгезии. Так, на фоне энзимотерапии достоверное и очень небольшое снижение РТМ отмечено только к 3-му часу постнагрузочного периода с быстрым возвращением к исходным показателям уже на 6-ом часе наблюдения. Величина снижения болевого порога (гиперчувствительность к механическому давлению на мышцу) на фоне SET также была ниже по абсолютным значениям по сравнению с плацебо. Эффективность системной энзимотерапии в отношении маркеров воспаления возрастала по мере увеличения интенсивности тренировок и не коррелировала с изменением функциональных показателей. Авторы делают заключение, что пероральное применение стандартизированного протеолитического ферментного комплекса (Вобензим) по 4 таблетки три раза в день за 30 минут до еды в течение 72 часов до и 72 часов после истощающих эксцентрических упражнений (изокинетическая нагрузка на мышцы) способствует поддержанию максимальной концентрической силы и препятствует развитию мышечной гиперальгезии у физически активных лиц с умеренным уровнем тренированности, и достоверно снижает показатели воспаления, вызванного физическими нагрузками у всех категорий тренирующихся лиц. Тем не менее, для окончательных выводов авторы рекомендуют расширить направления исследований SET в отношении EIMD и DOMS за счет других категорий спортсменов и видов нагрузок.
Еще одним важным механизмом системного действия протеолитических ферментов, который способствует как анаболическому эффекту, так и снижению DOMS, может быть увеличение уровней тестостерона. В рандомизированном двойном-слепом плацебо-контролируемом исследовании C.M.Shing и соавторов[31] бромелаин (1000 мг/день) снижал EIMD и DOMS, ускоряя восстановление у велосипедистов (15 профессиональных гонщиков, возраст 22±1,2 года, рост 1,79±0,01 см, масса тела 68,7±1,97 кг), участвующих в напряженных шестидневных гонках. Образцы крови брались у каждого участника в первый, третий и шестой дни гонок для оценки уровней креатинкиназы (биохимический маркер повреждения мышц - CK), миоглобина, лактат дегидрогеназы (LDH) и тестостерона. В обеих группах во все дни тестирования были повышены такие показатели как CK, LDH и миоглобин. Концентрация тестостерона у всех участников в последний день заездов была достоверно понижена, однако на фоне приема бромелаина отмечена тенденция к поддержанию более высокого уровня тестостерона, чем в контрольной группе, в течение всего шестидневного цикла соревнований. В группе спортсменов, принимавших бромелаин, также отмечено достоверное (Р=0,01) замедление развития усталости. Авторы делают вывод, что курсовой 6-дневный прием бромелаина в дозе 1000 мг/день профессиональными велосипедистами в течение всего соревновательного периода снижает EIMD и DOMS, субъективное чувство усталости, а также предупреждает падение уровней тестостерона, вызываемое постоянной пролонгированной физической нагрузкой. Из этого вытекают конкретные рекомендации для применения ПФ, содержащих бромелаин, в соревновательный период в циклических видах спорта.
Побочные эффекты перорального приема протеолитических ферментов[править | править код]
В целом, побочные эффекты протеолитических ферментов наблюдаются достаточно редко. Они возникают, как правило, при применении избыточных доз, либо как аллергические реакции на свиной или коровий белок, либо как повышенная реакция на активные компоненты папайи и ананаса. Чаще всего побочные эффекты ПФ выражаются в нарушении функции ЖКТ. С целью предупреждения реакций гиперчувствительности, следует предварительно выяснить переносимость ПФ в анамнезе, и контролировать эффект первых дней назначения. Гиперурикозурия (избыток мочевой кислоты в моче) и гиперурицемия (повышение мочевой кислоты в крови) также являются показателями избыточного перорального потребления ПФ[32], что может служить индикатором в процессе НМТ.
Грибковые протеазы – новое направление в создании ферментных фармаконутриентов для спортивной медицины[править | править код]
Развитие данного направления связано с выделением и изучением группы протеаз грибкового происхождения (Aspergillus niger и Aspergillus oryzae) в виде патентованной формулы Aminogen®. J.Oben и соавторы[33] провели исследование в двух группах здоровых мужчин (n=21, возраст 19-35 лет, ИМТ 20-24, физическая активность в рамках программы бодибилдинга). В течение первых 9 дней участники принимали (на фоне стандартизированной сбалансированной диеты в 2200 ккал/день, 40% углеводов, 25% белка и 35% жиров) 50 г концентрата WP (WPC), затем 50 г WPC с добавлением либо 2,5 г, либо 5 г Аминогена (Aminogen®, Triarco Industries,Wayne, NJ). WPC представлял собой порошок с содержанием 85% протеина, 6% жира, 3% неорганических веществ и 6% лактозы. На каждом этапе исследования (каждые 30-60 минут) брались образцы крови для оценки уровней аминокислот и С-реактивного белка в крови. Результаты показали, что в группах, получавших дополнительно грибковые протеазы, уровень всех аминокислот был через 4 часа после приема пищевых добавок достоверно выше, чем в контроле (увеличение площади под кривой AUC – «время-концентрация»). На фоне ферментов достоверно снижался С-реактивный белок по сравнению с контрольной группой, улучшался азотистый баланс. Авторы сделали заключение, что Аминоген усиливает переваривание белка в ЖКТ и скорость всасывания аминокислот (в 2,2-3,5 раза). Не прослеживалось достоверной связи между дозой ферментов и конечным результатом, что позволяет рассматривать дозу Аминогена 2,5 г как адекватную и достаточную. С практической точки зрения это означает, что грибковые протеазы, с одной стороны, повышают эффективность переваривания белка и всасывание аминокислот в среднем в 2,5 раза (растет уровень аминокислот в плазме крови), а с другой, организм получает возможность потребления дополнительного количества белка, который в обычных условиях не может быть переработан и усвоен собственными эндогенными протеазами (адекватный, т.е. усвояемый, однократный объем белка в обычных условиях – 15 г, на фоне ферментов – 30 г и более). В свою очередь, это приводит к снижению риска белковой перегрузки и вероятности диспептических явлений и желудочно-кишечного дискомфорта. Снижение уровней С-реактивного белка может вносить вклад в торможение процессов воспаления при физических нагрузках, уменьшение негативных последствий чрезмерного мышечного напряжения и ускорение восстановления в постнагрузочный период.
Безопасность курсового приема Аминогена у здоровых лиц (n=40, возраст 27,1±7,9 года) в режиме постоянных силовых тренировок в течение 30 дней в сочетании с потреблением whey-протеина изучена в работе M.L.Anderson[34]. Регистрируемые параметры включали различные маркеры общего состояния здоровья, метаболических функций, работы гепато-ренальной системы детоксикации и выведения веществ из организма, состояния сердечно-сосудистой системы, включая липидный обмен. В рандомизированном двойном-слепом плацебо-контролируемом исследовании испытуемые были разделены на группы А и В. В группе А осуществлялся прием WP дважды в день по 40 г с добавлением Аминогена, в группе В – то же самое, но без Аминогена. Между группами не выявлено различий по общим показателям физического здоровья, метаболических, сердечно-сосудистых и гепато-ренальных функций. Однако в группе В (без Аминогена) отмечено достоверное (P<0,05) повышение таких атерогенных факторов как общий холестерол, липопротеиды низкой плотности (LDL) и уровень кальция в плазме крови. В целом Аминоген хорошо переносился без заметных побочных явлений и изменений основных маркеров безопасности в сыворотке крови.
Также, как и в случае других растительных и животных протеаз, Аминоген выпускается в виде отдельной пищевой добавки, а также может включаться в состав готовых патентованных протеиновых смесей в соотношениях, обеспечивающих максимальный уровень расщепления протеинов при пероральном приеме и всасывания аминокислот в кишечнике (например: Optimum Nutrition Gold Standard Natural 100% Whey - сывороточный протеин при содержании Аминогена примерно 67 мг на 100 г продукта; протеин гороха с добавлением Аминогена из расчета 250 мг ферментов на 25 г белка – Pea Protein Organic). Производители позиционируют преимущества своих продуктов за счет добавления Аминогена как: увеличение высвобождения ВСАА на 250%; повышение уровня аминокислот плазмы крови на 100%; L-глутамина – на 90%; L-аргинина – на 80%; улучшение азотистого баланса на 32%; постепенное повышение ТМТ и ускорение восстановления. Однако, на сегодняшний день следует с осторожностью относиться к рекламному стилю компаний-производителей, поскольку не всегда четко сформулированные регуляторные правила в отношении пищевых добавок, позволяют производителю вольно трактовать результаты научных исследований. Эмпирически считается, что минимальная эффективная дозировка Аминогена для сывороточного протеина составляет 50 мг на 1 г белка (5% к весу белка), но для растительных белков она не определялась.
Заключение[править | править код]
Исследования последних десяти лет позволили сформулировать концепцию полимодальности механизма действия протеолитических ферментов (ПФ) животного, растительного и комбинированного происхождения в спортивной медицине. Условно этот механизм складывается из двух взаимодополняющих частей: усиление и ускорение переваривания белка в ЖКТ и системное антипротеолитическое действие (снижение воспаления, уменьшение EIMD и DOMS. Основные положения этих направлений могут быть сформулированы следующим образом:
- «Классическое» локальное действие в ЖКТ (преимущественно в кишечнике), основано на ферментативном расщеплении протеинов до пептидов и аминокислот (АК), усилении переваривания протеинов, ускорении высвобождения АК, включая ВСАА и глутамин, и абсорбции легких пептидов и АК в кишечнике при абсолютной или относительной недостаточности эндогенного образования протеаз. С точки зрения данного механизма, ПФ выступают как катализаторы анаболического действия АК, в первую очередь, ВСАА.
- В большинстве случаев при формировании состава комбинированных протеолитических препаратов используются растительные протеазы цистеина – бромелаин (обязательный компонент) и папаин, а также протеазы серина животного происхождения – трипсин и химотрипсин. Популярной формой выпуска являются кишечнорастворимые таблетки, покрытые оболочкой, для обеспечения наибольшей концентрации активных веществ в кишечнике (предотвращение распада таблетки в кислой среде желудка).
- Прием протеолитических ферментов обеспечивает усвоение организмом физиологически активных протеинов с высоким молекулярным весом. Фармакокинетические исследования показывают дозо-зависимое линейное нарастание концентрации протеаз в различных средах организма, варьирующее в достаточно широких индивидуальных пределах, медленную динамику абсорбции в кишечнике, быстрое и 100% связывание в организме с антипротеазными комплексами. Пероральный прием ПФ увеличивает протеазную активность сыворотки крови с параллельным возрастанием концентрации в плазме крови соответствующих антипротеаз.
- Повышение эффективности высвобождения аминокислот из белка под влиянием ПФ позволяет использовать меньшие дозы протеинов и снизить риск возникновения побочных эффектов, связанных с избыточным потреблением молочных протеинов (снижение переваривания, повышенное газообразование, диспептические нарушения и т.п.).
- Смесь протеаз различного происхождения при совместном приеме с whey-протеинами (WPC, WPI) увеличивает и оптимизирует во времени высвобождение из белков ВСАА и глутамина с последующей активацией mTOR, что определяет анаболическую эргогенную активность ПФ. Эргогенное действие ПФ носит опосредованный характер и проявляется при выборе оптимального соотношения общего количества и качества поступающего белка, собственной активности эндогенных ПФ и количества и протеолитических свойств экзогенных ПФ в составе препаратов и БАДов. Конечным эффектом оптимального приема пищевых добавок протеинов и ПФ в сочетании с силовыми тренировками является увеличение синтеза белка в скелетных мышцах, увеличение размеров мышечных волокон, повышение силы и мощности мышц.
- Курсовой 6-дневный прием ПФ (превентивный и сопровождающий) в дозе 500-1000 мг/день в циклических видах спорта в течение соревновательного периода снижает EIMD и DOMS, субъективное чувство усталости, а также предупреждает падение уровней тестостерона, вызываемое постоянной пролонгированной физической нагрузкой.
- Пероральное применение стандартизированного протеолитического ферментного комплекса (Вобензим) по 4 таблетки три раза в день за 30 минут до еды в течение 72 часов до и 72 часов после истощающих эксцентрических упражнений способствует поддержанию максимальной мышечной силы и препятствует развитию мышечной гиперальгезии у физически активных лиц с умеренным уровнем тренированности, и достоверно снижает показатели воспаления, вызванного физическими нагрузками у всех категорий тренирующихся лиц.
- Относительно новым направлением системной энзимной терапии (СЭТ) в спортивной медицине является применение протеаз грибкового происхождения. Грибковые протеазы, с одной стороны, повышают эффективность переваривания белка и всасывание аминокислот в среднем в 2,5 раза (растет уровень аминокислот в плазме крови), а с другой, организм получает возможность потребления дополнительного количества белка, который в обычных условиях не может быть переработан и усвоен собственными эндогенными протеазами (адекватный, т.е. усвояемый, однократный объем белка в обычных условиях – 15 г, на фоне ферментов – 30 г и более). В свою очередь, это приводит к снижению риска белковой перегрузки и вероятности диспептических явлений и желудочно-кишечного дискомфорта. Снижение уровней С-реактивного белка может вносить вклад в торможение процессов воспаления при физических нагрузках, уменьшение негативных последствий чрезмерного мышечного напряжения и ускорения восстановления в постнагрузочный период. Препараты грибковых протеаз имеют хороший профиль безопасности, а также улучшают липидный профиль сыворотки крови, что может иметь практическое значение при длительном использовании в старших возрастных группах тренирующихся лиц.
Применение ферментов позволяет использовать более приятные по органолептическим свойствам белковые смеси, содержащие нативные высококачественные протеины (например, WP, а не гидролизаты WPH). Такой подход (ферментирование белков «in vivo») является альтернативой промышленной ферментативной обработке белков до поступления в организм. При этом образование и абсорбция ВСАА (в частности, лейцина) в количественном плане идентичен эффективности уже ферментированных белков или добавок ВСАА в составе смесей.
В спорте высших достижений, где в подавляющем большинстве случаев имеет место относительная ферментная недостаточность, обусловленная большим объемом поступления белка (в составе диеты, функциональной пищи или добавок протеинов различного происхождения), задачей ферментных препаратов является адекватное переваривание дополнительных протеинов. Соответственно, расчет потребности в экзогенно вводимых ферментах осуществляется, исходя из имеющегося превышения возрастной нормы потребления белка, антропометрических показателей спортсмена и реальной физической нагрузки в процессе тренировок и соревнований, функционального состояния кислотообразующей и ферментообразующей функции ЖКТ.
Читайте также[править | править код]
- BCAA: научный обзор
- L-карнитин: научный обзор
- АТФ: научный обзор
- Бета-аланин: научный обзор
- Глутамин: научный обзор
- HMB: научный обзор
- Донаторы оксида азота: научный подход
- Кетоаналоги аминокислот
- Креатин: научный обзор
- Нейростимуляторы и нейропротекторы в спортивном питании: научный обзор
- Омега-3 жирные кислоты: научный обзор
- Омега-5 жирные кислоты: научный обзор
- Омега-7 жирные кислоты: научный обзор
- Спортивные напитки: научный обзор
- Препараты витамина D в спортивной медицине: научный обзор
Ссылки[править | править код]
- ↑ Roxas M. The role of enzyme supplementation in digestive disorders. Alt.Med.Rev., 2008, 13: 307-314.
- ↑ 2,0 2,1 Пенджиев А.М., Абдуллаев А. Эффективность использования протеолитических ферментов папайи в медицинской практике. Медицинские Науки, 2017, 1:57-72.
- ↑ Leipner J., Iten F., Saller R. Therapy with proteolytic enzymes in rheumatic disorders. Biodrugs, 2001, 15: 779-789.
- ↑ Leipner J., Saller R. Therapy with proteolytic enzymes in oncology. Drugs, 2001, 59: 769-780.
- ↑ 5,0 5,1 5,2 5,3 Lorkowski G. Gastrointestinal absorption and biological activities of serine and cysteine proteases of animal and plant origin: review on absorption of serine and cysteine proteases. Review. Int.J.Physiol.Pathophysiol.Pharmacol., 2012, 4(1):10-27.
- ↑ 6,0 6,1 Maurer H.R. Bromelain: biochemistry, pharmacology and medical use, Cellular and Molecular Life Sciences, 2001, 58(9): 1234–1245.
- ↑ 7,0 7,1 Bhattacharyya В.К. Bromelain: an overview, Natural Product Radiance, 2008, 7(4):359–363.
- ↑ Pavan R., Shraddha J.S., Kumar A. Properties and Therapeutic Application of Bromelain: A Review. Hindawi Publishing Corporation Biotechnology Research International, 2012, Article ID 976203, 6 pages, doi:10.1155/2012/976203.
- ↑ Rathnavelu V., Alitheen N.B., Sohila S. et al. Potential role of bromelain in clinical and therapeutic applications (Review). Biomedical Reports, 2016, 5: 283-288.
- ↑ Yoshioka S., Izutsa К., Asa Y., Takeda Y., Inactivation kineticsof enzyme pharmaceuticals in aqueous solutions, Pharmaceutical Research, 1991, 4, 480–485.
- ↑ Barrett A.J., Rawlings N.D. Perspectives in biochemistry and biophysics. Families and Clans of serine peptidases. Arch.Biochem.Biophys., 1995, 318(2):247-250.
- ↑ Page M.J., Di Cera E. Serine peptidases: Classification, structure and function. Cell Molec.Life Sci., 2008, 65(7):1220-1236.
- ↑ Веремеенко К. Н. Протеолитические ферменты поджелудочной железы и их применение в клинике. Киев, 1967. - 160 с.
- ↑ Кулаков В.И., Насонова В.А., Савельев В.С.. Системная энзимотерапия. Опыт и перспективы. СПб.: Интер-Медика. 2004. – 264 с.
- ↑ Seifert J., Siebrecht P., Lange J.P. Quantitative Untersuchungen zur Resorption von Trypsin, Chymotrypsin, Amylase, Papain und Pankreatin aus dem Magen-Darm-Trakt nach oraler Applikation. Allgemeinmedizin 1990, 19: 132-137.
- ↑ Seifert J., Siebrecht D., Lange J.P. et al. The quantitative absorption or orally administered proteins and histological evidence of enzymes in the wound. In: Gardner MLG, Steffens K.J., editors. Absorption of orally administered Enzymes. Berlin: Springer Verlag, 1995, 29-38.
- ↑ Seifert J., Ganser R., Brendel W. Absorption of a proteolytic enzyme originating from plants out of the gastro-intestinal tract into blood and lymph of rats. Z Gastroenterol., 1979, 17: 1-8.
- ↑ 18,0 18,1 Castell J.V. Intestinal absorption of undegraded Bromelain in humans. In: Gardner MLG, Steffens K.J., editors. Absorption of orally administered Enzymes. Berlin: Springer Verlag, 1995, 47-60.
- ↑ 19,0 19,1 Castell J.V., Friedrich G., Kuhn C.S., Poppe G.E. Intestinal absorption of undegraded proteins in men: presence of bromelain in plasma after oral intake. Am.J.Physiol., 1997, 273: G139-146.
- ↑ 20,0 20,1 Roots I., Donath F., Rex A., Mai I. Pilotstudie zur Untersuchung der relativen Bioverfugbarkeit von Trypsin aus zwei Peroralia. Institut fur Klinische Pharmakologie, Berlin 1995.
- ↑ 21,0 21,1 Donath F., Roots I., Mai I. et al. Dose-related bioavailability of bromelain and trypsin after repeated oral administration. Eur J Pharmacol 1997; 52: A146.
- ↑ 22,0 22,1 Roots I. Bioverfugbarkeit von Trypsin, Bromelain und Rutin-Metaboliten nach oraler Gabe von Phlogenzym® bei gesunden Probanden. Randomisierte doppelblinde Crossover-Studie gema? GCP. Study No MU- 695 427. Institut fur Klinische Pharmakologie der Med. Fakultat Humboldt-Universitat Berlin, Germany 1997.
- ↑ Bartos J. A proprietary enzyme blend designed and optimized to efficiently release BCAAs and glutamine, promoting heightened mTOR activation – for better protein synthesis and skeletal muscle growth. Glanbia Nutrition, IGNITOR, White paper, 2014.
- ↑ Walker A.F., Bundy R., Hicks S.M., Middleton R.W. Bromelain reduces mild acute knee pain and improves well-being in a dose-dependent fashion in an open study of otherwise healthy adults. Phytomedicine, 2002, 9(8):681-686.
- ↑ Beck T.W., Housh T.J., Johnson G.O. et al. Effects of a protease supplement on eccentric exercise-induced markers of delayed-onset muscle soreness and muscle damage. J.Strength Cond.Res., 2007, 21(3):661-667.
- ↑ Orsini R.A. Bromelain. Safety and efficacy report. Plastic and Reconstructive Surgery, 2007, DOI: 10.1097/01.prs.0000242503.50548.ee.
- ↑ Buford T.W., Cooke M.B., Redd L.L. et al. Protease supplementation improves muscle function after eccentric exercise. Med.Sci.Sports Exerc., 2009, 41(10):1908-1914.
- ↑ 28,0 28,1 Udani J.K., Singh B.B., Singh V.J., Sandoval E. BounceBack™ capsules for reduction of DOMS after eccentric exercise: a randomized, double-blind, placebo-controlled, crossover pilot study. Journal of the International Society of Sports Nutrition 2009, 6:14-20.
- ↑ 29,0 29,1 Miller P.C., Bailey S.P., Barnes M.E. et al. The effects of protease supplementation on skeletal muscle function and DOMS following downhill running. J.Sports Sci., 2004, 22, 365–372.
- ↑ 30,0 30,1 30,2 Marzin T., Lorkowski G., Reule C. et al. Effects of a systemic enzyme therapy in healthy active adults after exhaustive eccentric exercise: a randomised, twostage, double-blinded, placebo-controlled trial. BMJ Open Sport Exerc.Med., 2017;2: e000191. doi:10.1136/bmjsem-2016-000191.
- ↑ Shing C.M., Chong S., Driller M.W., Fell J.W. Acute protease supplementation effects on muscle damage and recovery across consecutive days of cycle racing. Eur.J.Sport Sci., 2016, 16(2): 206-212.
- ↑ Cichoke A.J. Pancreatic enzymes. In: Pizzorno J.and Murray M., editors. Textbook of Natural Medicine. St Louis, MO: Churchill Livingstone, 2006; pp.1131-1146.
- ↑ Oben J., Kothari S.C., Anderson M.L. An open label study to determine the effects of an oral proteolytic enzyme system on whey protein concentrate metabolism in healthy males. J.Int.Soc. Sports Nutr., 2008, 5:10.
- ↑ Anderson M.L. A Double-Blind Clinical Study to Investigate the Effects of a Fungal Protease Enzyme System on Metabolic, Hepato-renal, and Cardiovascular Parameters Following 30 Days of Supplementation in Active, Healthy Men. Food Dig., 2013, 4:19–25.